CROSSJECT - News - Reco - Page 9
Cours temps réel: 2,235 0,68%| Cours | Graphes | News | Analyses et conseils | Historiques | Vie du titre | Secteur | Forum |
Crossject annonce le lancement d’une augmentation de capital avec maintien du droit préférentiel de souscription d’un montant d’environ 8 millions d’euros pour renforcer ses sources de financement de l’enregistrement de ZEPIZURE® et de son expansion aux Etats-Unis
Emission d’Actions Nouvelles pour un montant total de près de 8 millions d’euros avec maintien du Droit Préférentiel de Souscription (« DPS ») des actionnaires
Augmentation de capital sécurisée par Gemmes Venture, actionnaire de référence de Crossject depuis sa création, à travers un engagement de souscription à titre irréductible pour un montant total d’environ 1,96 million d’euros (soit 24,48% de l’augmentation de capital) et d’une garantie pour un montant total de près de 6 millions d’euros (soit 75% de l’augmentation de capital)
Prix de souscription des Actions Nouvelles fixé à 1,848 euro, soit une décote de 10% par rapport au cours de clôture le jour de la fixation des modalités de l’opération par le Directoire de la Société
Période de souscription du 16 mai 2024 au 30 mai 2024 inclus
|
Répondre
|
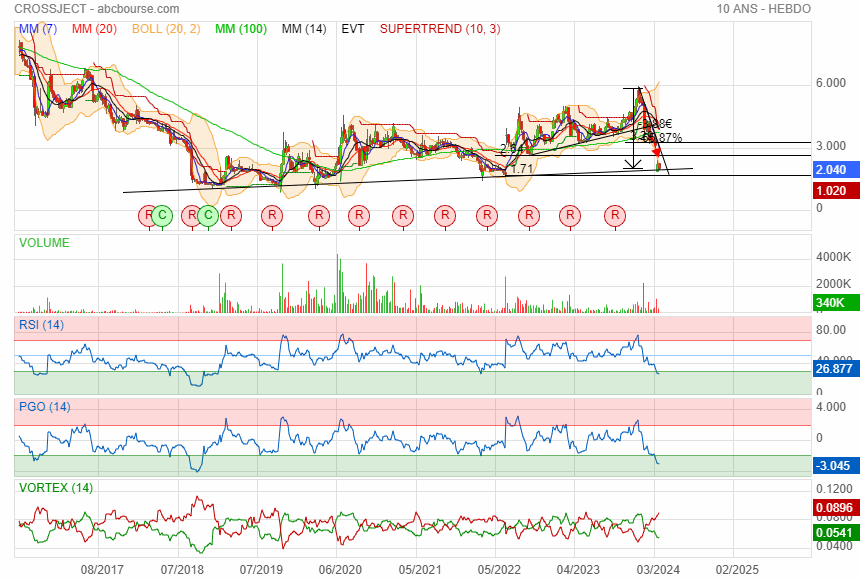
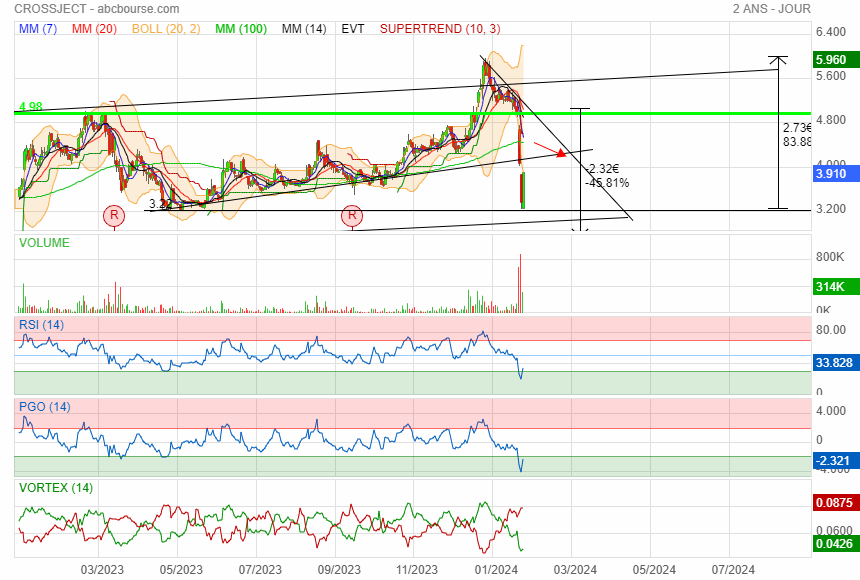
Perdu 65 % de sa valeur en 3 mois
Zone de consolidation à ce niveau j' attend de voir
|
Répondre
|
Publié le 3 avr. 2024
Crossject a prévenu, hier, à l’occasion de la publication de ses comptes 2023, que l’aval des autorités sanitaires américaines pour la commercialisation de Zepizure était désormais attendu pour le premier trimestre 2025, soit avec un an de retard sur le calendrier.
La medtech, qui a mis au point un dispositif, Zepizure, qui permet des injections d’urgence sans aiguille en cas de crise d’épilepsie, chute aujourd’hui de 40% en Bourse, ce qui porte son plongeon à 70% depuis son pic pluriannuel touché en janvier, à près de 6 euros l’action.
Son système de piqûre sans aiguille propulsant du benzodiazépine à très grande vitesse, est, par ailleurs, testé, sous un autre nom (avec une autre molécule), contre l’asthme sévère, les overdoses, la migraine ou le choc allergique, mais l’indication épileptique est celle qui intéresse tout particulièrement la Bourse. Les investisseurs attendaient avec impatience l’autorisation d’utilisation d’urgence (EUA) aux Etats-Unis [comme celle qui a prévalu pour les vaccins lors de la crise du Covid], qui aurait permis de déclencher des premières livraisons dans le cadre du contrat avec la Barda.
La Barda est la Biomedical Advanced Research and Development Authority ou l'autorité américaine pour la R&D avancée dans le domaine biomédical, placée dans le giron du ministère de la Santé.
En juin 2022, l’entreprise dijonnaise a remporté un contrat de 60 millions de dollars avec les Etats-Unis pour le développement et la fourniture de son dispositif d'administration rapide d'un antiépileptique, détourné à des fins de lutte contre les conséquences d’une attaque chimique.
Levée de fonds
Crossject explique le retard dans le calendrier par un changement de sous-traitant. « Notre organisation de supply chain, qui comprend aujourd’hui un nouveau partenaire de premier plan, Eurofins Scientific, comme façonnier spécialiste des injectables, a été discutée avec la Barda et la FDA. Bien que ces changements ont entraîné historiquement des retards, nous pensons que notre niveau d’automatisation accru renforce notre supply chain et permet de sécuriser aujourd’hui les volumes sous-tendant tous nos programmes », lit-on dans un communiqué.
Mais, comme l’indique le cabinet d’analyse financière Invest Securities, « ce décalage a des conséquences sur la visibilité financière avec un besoin additionnel pour atteindre la commercialisation. » Crossject, qui vit sur sa trésorerie en attendant des rentrées d’argent issues de la vente de son produit, va devoir lever de nouveaux fonds. Le besoin s’élève, selon Invest Securities, à 5 millions d’euros.
|
Répondre
|
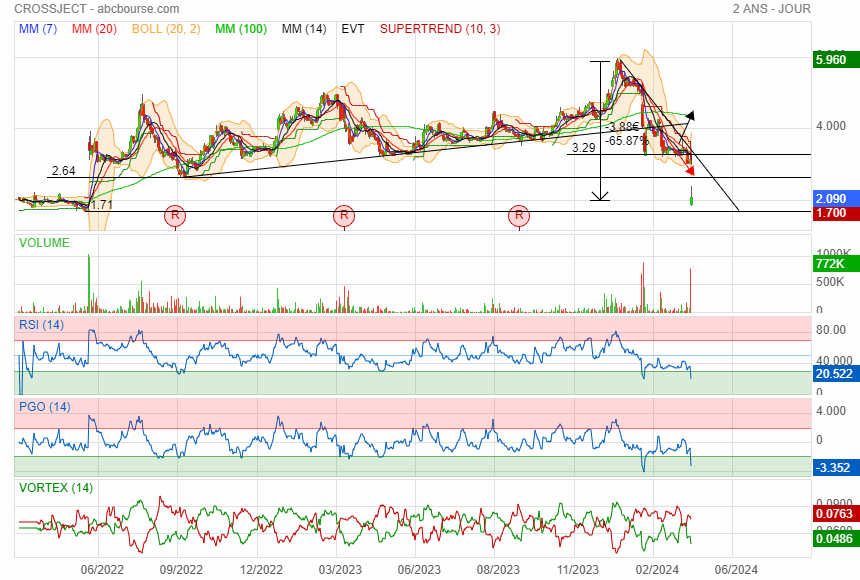
Support 1.71 en ligne de mire
|
Répondre
|
La patience est une vertu... espérons-le
Le groupe a surpris en publiant un communiqué de presse sur les progrès réalisés dans sa stratégie américaine et une série de résultats (très résumés) pour l’année fiscale 23. Nous voyons surtout des points négatifs dans ce communiqué et l’espoir de voir Zeneo atteindre le marché américain par le biais d’une EUA en FY24 s’est évanoui… nous réviserons nos chiffres à la baisse après la publication des résultats détaillés de FY23, notamment en reportant le lancement des NTE du groupe.
ACTUALITÉ
Crossject a publié un communiqué de presse détaillant sa stratégie américaine et publiant ses comptes annuels (partiels) pour l’exercice 23 (le rapport complet est attendu le 24 avril).
ANALYSE
Tout d’abord, ce communiqué est une surprise puisque, comme nous l’avons déjà mentionné, le rapport annuel est attendu pour le 24 avril. Deuxièmement, ce communiqué est plutôt une mauvaise nouvelle pour les investisseurs. En effet :
- Le groupe attend désormais l’EUA pour Zepizure aux Etats-Unis au plus tôt au cours du T1 2025 (le dernier objectif communiqué était FY23/Q124 et les nouvelles d’aujourd’hui ne peuvent que décevoir les investisseurs).
- Le groupe a également indiqué qu’il était en mesure de financer son plan d’affaires jusqu’en… septembre 2024. Notons qu’il a émis 7 M€ d’obligations en février (voir notre Dernière en date du 28 février 2024) et le communiqué souligne clairement qu’il y aura d’autres financements à court terme, ce qui implique une nouvelle dilution à notre avis.
- Cela empêchera le groupe de demander le tirage total ou partiel de la seconde tranche de la dernière émission obligataire (jusqu’à 5 millions d’euros) à court terme (ce qui aurait pu être le cas à partir de juillet sinon) puisque les conditions ne seront pas remplies rapidement (au mieux l’année prochaine).
- Dans une moindre mesure, le compte de résultat affiche toujours une perte assez importante (-12,3 millions d’euros contre -13,3 millions d’euros il y a un an au niveau opérationnel), et ce malgré le montant facturé à la BARDA (6,7 millions d’euros contre 1,8 million d’euros). Bien que cela ait été prévu – c’est-à-dire des coûts plus élevés du côté du développement partiellement compensés par la BARDA – il n’en reste pas moins que le P&L ne semble pas beaucoup mieux que l’année dernière et implique que le groupe brûle toujours un montant significatif de liquidités.
- Nous ne comprenons pas pourquoi l’ensemble des comptes n’a pas été publié (ou pourquoi nous avons ce rapport très partiel), ce qui ne facilite guère la vie des investisseurs.
Le groupe prévoit également de déposer en H125 une demande de NDA (New Drug Application) pour Zepizure et “travaille sur les activités liées à son enregistrement et à sa pré-commercialisation aux Etats-Unis, puisque Crossject a l’intention de conserver les droits commerciaux américains de Zepizure”. Le groupe devra “seulement” démontrer la bioéquivalence de Zepizure (par rapport à d’autres produits injectables). C’est une bonne chose. Mais cela signifie que ces produits ne pourront certainement pas être mis sur le marché avant l’année fiscale 26, au mieux. La question clé à court terme reste le financement et le marché sera probablement heureux d’attendre d’en savoir plus sur ce point avant que la dynamique de l’action puisse s’améliorer et la réaction du marché à court terme sera très probablement négative.
IMPACT
Nous ajusterons notre modèle après la publication des résultats détaillés de l’exercice 23 (24 avril). La grande différence sera le calendrier de lancement des produits ainsi que la dilution (sur laquelle nous devrons faire un certain nombre d’hypothèses). Ces deux éléments ne peuvent évidemment que conduire à une valorisation plus faible, comme nous l’avions déjà souligné après l’annonce de l’émission obligataire en février dernier.
|
Répondre
|
😲☹️⏬ On va aller jusqu'où comme ça !!! ⏬
|
Répondre
|
Crossject poursuit sa stratégie de développement aux États-Unis et publie ses résultats financiers pour 2023
Amélioration notable de la visibilité sur les perspectives règlementaires et commerciales aux États-Unis depuis les derniers échanges avec la FDA.
Attente d’une obtention de l’Autorisation d’Utilisation d’Urgence (EUA) aux États-Unis pour ZEPIZURE® pour T1 2025.
Attente d’un dépôt de la demande d’autorisation de mise sur le marché (NDA) de ZEPIZURE® aux États-Unis pour S1 2025.
Renforcement de la supply chain avec l’addition d’un second façonnier.
Annonce d’une réduction de la perte nette à 8,5 millions d’euros contre 11,2 millions en 2022.
Suite sur le site CROSSJECT...
|
Répondre
|
Ça fait le yo-yo depuis pas mal de temps... ☹️
|
Répondre
|
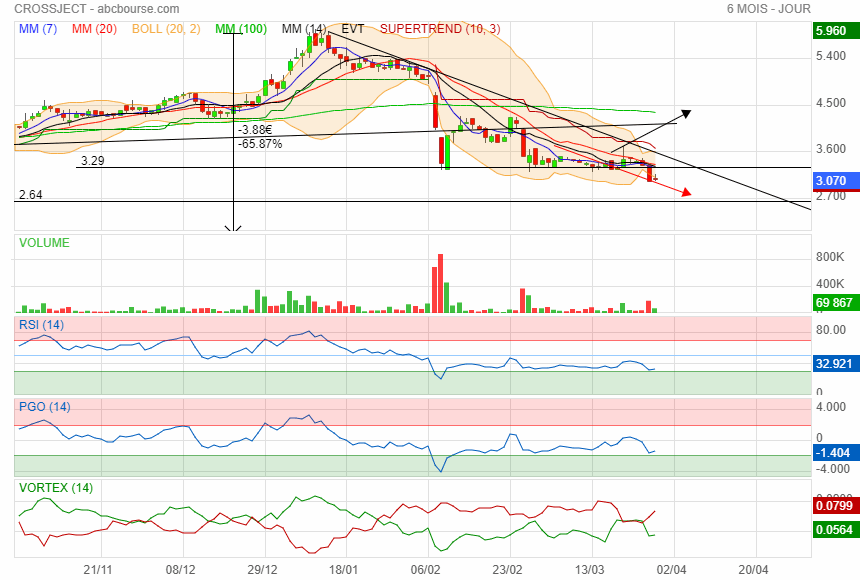
Comme on peut le voir le support des 3.29 n'a pas tenu
c est mal barré !
|
Répondre
|
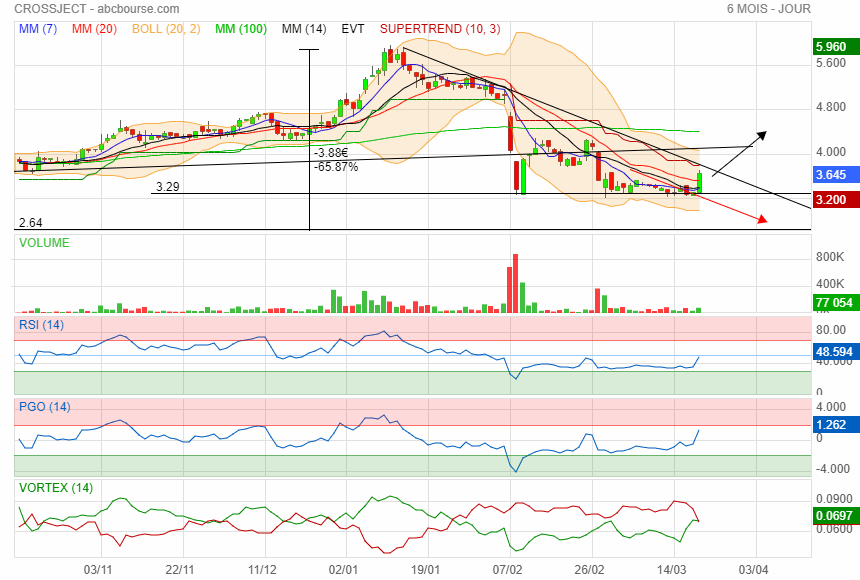
on dirait bien que si
spéculation ou nouvelles ??
|
Répondre
|
j'ai bien peur que ma ligne ne suffise pour la retenir
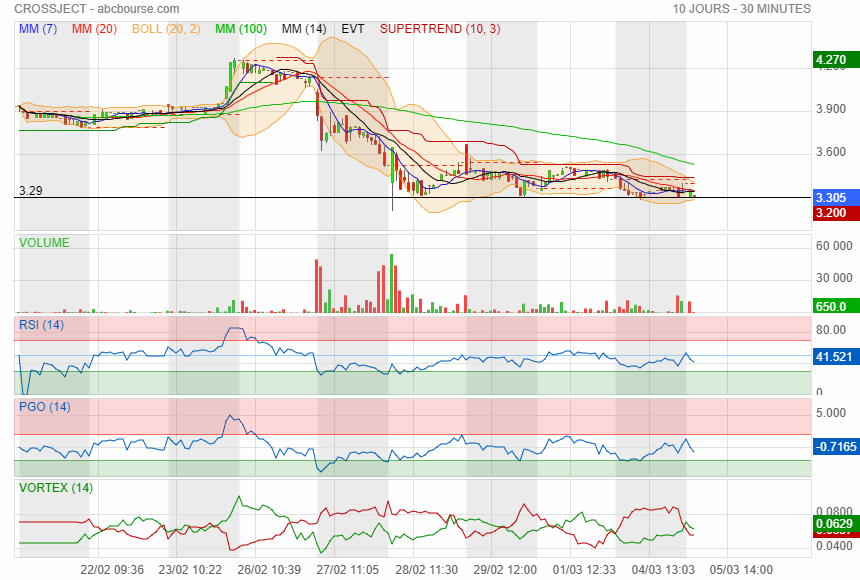
|
Répondre
|
3.30 à surveiller
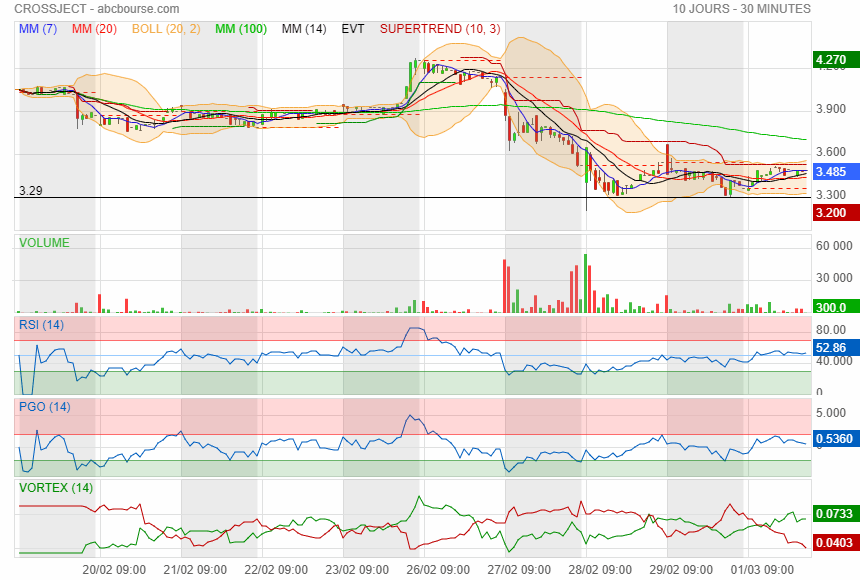
|
Répondre
|
Douche froide
effectivement la ces plus des rumeurs
premier support à 3.29 puis 2.64
et puis ensuite direction le gap
on en est pas encore la
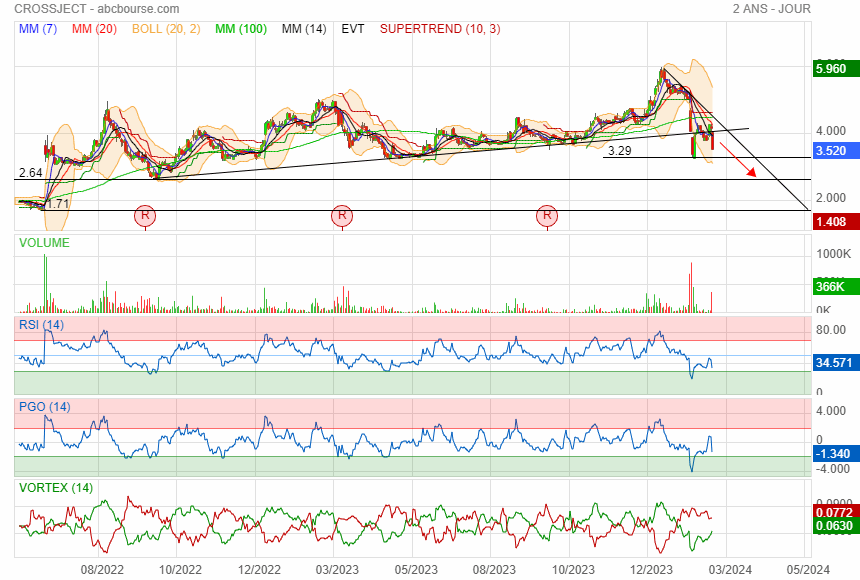
|
Répondre
|
(Boursier.com) — Crossject annonce l'émission, avec suppression du droit préférentiel de souscription au profit d'une catégorie de personnes, de 70 Obligations Convertibles en Actions Nouvelles et Amortissables (OCAs) d'une valeur nominale de 100.000 euros chacune, et pour un montant brut de 7 millions d'euros, conformément à la 13ème résolution de l'assemblée générale mixte du 7 juin 2023 et à la décision prise le 26 février 2024 par un membre du Directoire agissant dans le cadre de la subdélégation consentie par le Directoire lors de sa réunion en date du 23 février 2024 sur autorisation du Conseil de Surveillance en date du 29 janvier 2024. "Nous sommes fiers de réunir ces nouvelles ressources financières auprès d'une entité gérée par Heights Capital Management, Inc., investisseur institutionnel spécialisé dans le financement des sociétés en croissance, qui est un gage de confiance dans nos avancées industrielles et commerciales, en particulier sur le continent nord-américain", ajoute Patrick Alexandre, Président du Directoire.
Ces fonds s'ajoutent au financement actuel par la BARDA (dont 6,7 M$ facturés sur 2023 sur un budget global maximal de 32 M$), dans le cadre du contrat 75A50122C00031, pour le développement avancé de l'auto-injecteur ZENEO-midazolam (nom proposé ZEPIZURE) par approbation de la Food and Drug Administration des États-Unis pour la prise en charge de l'état de mal épileptique. Le contrat comprend également de futures perspectives pour la fourniture pour 60 M$ de ZEPIZURE, qui seront livrés au gouvernement américain, une fois le produit autorisé par la FDA pour utilisation d'urgence... La forme prise par le financement accordé par Heights "répond à notre objectif prioritaire d'avoir des solutions avec remboursement en numéraire au fil de l'eau et une dilution limitée", ajoute Patrick Alexandre.
Ce financement maximum de 12 ME vient s'ajouter aux autres financements non-dilutifs récemment sécurisés (opération de cession-bail immobilière pour environ 5 ME, préfinancement du Crédit Impôt Recherche 2023 pour 1,5 ME sur un total de de 3 ME, etc.) et aux revenus commerciaux liés aux partenariats nouveaux ou existants.
Le financement de Heights peut aller jusqu'à 12 millions d'euros et est composé de 2 tranches : une première tranche de financement de 7 millions d'euros pouvant être complété par une seconde tranche d'un montant maximum de 5 millions d'euros, à l'initiative de Crossject et sous réserve de la satisfaction de certaines conditions préalables.
COTATION
La Première Tranche passe par l'émission, avec suppression du droit préférentiel de souscription dans le cadre d'une catégorie de personnes telle que définie par l'assemblée générale du 7 juin 2023 au bénéfice de Heights, de 70 OCAs d'une valeur nominale de 100.000 euros chacune, la souscription par l'investisseur des 70 OCAs à hauteur de 90% de leur valeur nominale soit 6,3 millions d'euros (90.000 euros par OCA), et un règlement-livraison le 28 février 2024, sous réserve de la satisfaction de conditions usuelles. Le nombre d'actions nouvelles pouvant être émises au titre des OCAs sera compris entre 1.359.434 et 7.816.666 - 1.359.434 actions maximum en cas de conversion de la totalité des 70 OCAs au prix de conversion de 5,1492 euros fixé à 135% du prix de référence initial de 3,8142 euros (lequel est susceptible d'ajustements), ou, 2.383.420 actions maximum, en cas d'option par la société pour un amortissement en actions nouvelles des 70 OCAs (au prix plancher actuel de 3,2796 euros et dans la limite de détention de 9,99% du capital de la Société par l'Investisseur), ou 7.816.666 actions maximum, en cas d'option par la société pour un amortissement en actions nouvelles de tout ou partie des 70 OCAs (au nouveau prix plancher de 1 euro et dans la limite de détention de 9,99% du capital de la Société par l'investisseur).
Concernant la Seconde Tranche, le groupe indique que durant une période de douze mois à compter du 28 juin 2024 (soit à compter de la date de première échéance de remboursement de la Tranche 1 des OCAs), Crossject aura le droit (et non l'obligation) de solliciter le tirage total ou partiel de la Seconde Tranche dès lors que les conditions cumulatives suivantes seront satisfaites :
- Une AGE doit avoir approuvé l'émission de la Seconde Tranche des OCAs ;
- Crossject doit avoir reçu l'autorisation de la US Food and Drug Administration (FDA) afin de livrer les premières unités de ZEPIZURE au Strategic National Stockpile relatives au contrat entre Crossject et la BARDA ; et
- Le montant total en principal des OCAs émises au titre de la Seconde Tranche ne doit pas dépasser 10% de la capitalisation boursière de Crossject à la date à laquelle les conditions 1 et 2 sont satisfaites.
|
Répondre
|
Elle a refermer le 1 ier gap plus vite que prévue
Vient de repasser au-dessus de l'oblique !
A suivre
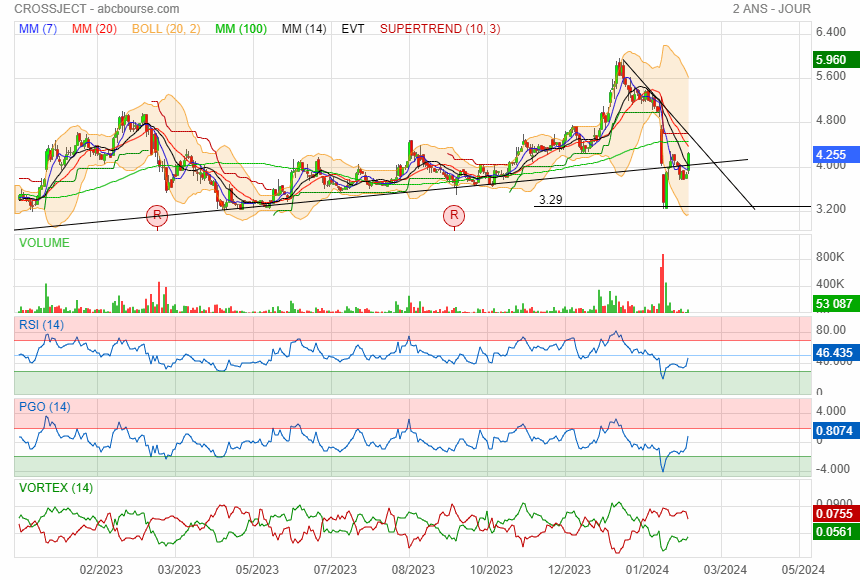
|
Répondre
|
le rebond a eu lieu avec du volume
perso je pense pas qu elle referme le gap 3.90 risque de devenir résistance on verra ces prochains jours
j ai presque tout revendu sur 3,84 acht sur 3.31
J ai bien limité la casse
maintenant j'attend de voir
|
Répondre
|
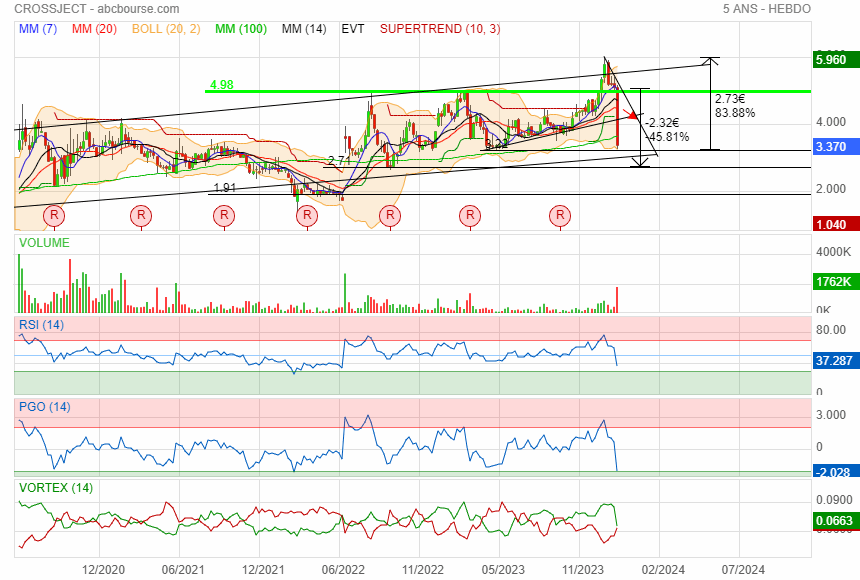
Dans l état actuel 1.80 sur une rumeur d Ak ca n'a pas de sens
Faire moins de 37% en 2 jours c est déjà pas mal
on va déjà voir comment elle réagit sur le support oblique vers 2.95 si elle descend si bas .
|
Répondre
|
1,8€ en ligne de mire
|
Répondre
|
CROSSJECT : Pas de nouvelles? Pas forcément une bonne nouvelle
Le 08 février 2024
STRATEGIC PLAN
La présentation de mardi dernier ne nous a pas vraiment renseignés (voire pas du tout) sur le développement du groupe sur la période récente. Nous regrettons qu’aucune nouvelle précision n’ait été donnée concernant les procédures de dépôt aux États-Unis (Emergency Use Authorization), en particulier en termes de calendrier. Nous déplorons également qu’il faille attendre aussi longtemps (soit jusqu’à fin avril !) pour avoir un aperçu sur les comptes annuels 2023 et les perspectives financières compte tenu des nouveaux besoins en matière de financement. En résumé, nous sommes déçus.
ACTUALITÉ
Le groupe a organisé un webcast le 6 février pour faire le point sur son développement sur la période récente et sa stratégie commerciale pour 2024.
ANALYSE
Pour commencer et pour être francs, nous avons trouvé la présentation plutôt “creuse”, commençant par un rappel de ce que propose Crossject, soit le(s) produit(s) qu’elle entend vendre et les progrès réalisés ces vingt dernières années.
Le groupe a rappelé qu’il avait conclu un accord aux Etats-Unis avec Syneos, un prestataire de services, qui devrait l’aider à déposer ses dossiers réglementaires aux États-Unis et à lancer commercialement son produit ZENEO une fois les autorisations accordées. En outre, le groupe a de nouveau confirmé poursuivre ses efforts pour faire approuver et commercialiser son ZEPIZURE (au travers notamment d’un accord de licence avec AFT Pharmaceuticals pour l’Australie et la Nouvelle-Zélande et d’un nouvel accord de commercialisation pour l’Europe du Nord). Il a ensuite réaffirmé son intention de se concentrer en 2024 sur les approbations réglementaires pour ZEPIZURE. Si l’ensemble de ces points vont dans le bon sens, ils ne sont pas nouveaux.
En janvier 2024, Crossject a engagé Syneos Health, groupe de services aux laboratoires biopharmaceutiques totalement intégré, pour la préparation au lancement commercial aux États-Unis de son auto-injecteur ZENEO-midazolam (nom proposé ZEPIZURE), un traitement d’urgence innovant dans la prise en charge des crises d’épilepsie y compris celles causées par l’exposition à un agent neurotoxique. Fortement implanté aux Etats-Unis, Syneos Health apportera une réelle expertise dans la commercialisation de nouvelles thérapies à Crossject, au moment même où ce dernier s’apprête à déposer une demande d’autorisation de mise sur le marché. Les principaux détails du contrat signé avec la BARDA aux États-Unis ont également été rappelés (cf. nos précédents commentaires sur le sujet).
Selon le groupe, les discussions avec la FDA concernant les exigences nécessaires à l’autorisation d’utilisation d’urgence de ZEPIZURE sont “en bonne voie”. Si nous ne doutons pas de sa véracité, cette déclaration ne devrait pas suffire à convaincre les investisseurs que les choses iront prochainement dans le bon sens.
Nous déplorons également qu’il faille attendre jusqu’au 24 avril pour la publication des comptes annuels 2023. Une telle attente nous paraît interminable compte tenu du niveau de trésorerie actuel et des éventuels besoins du groupe pour financer son développement avant le lancement commercial de ses produits. En juin 2023, la trésorerie atteignait 5,3m€, sachant bien sûr que la consommation de cash de Crossject devrait se poursuivre pendant encore un (assez) long moment. Au S1 2023, le free cash flow représentait -8,3m€, avec 4,5m€ de capex. Dans ce contexte, la réaction très mesurée du marché (avec un titre à environ -20%) s’explique (en partie) par le fait que face à de nouveaux besoins en termes de financement, le groupe pourrait avoir recours à des instruments dilutifs. Si la direction affirme vouloir faire de son mieux pour éviter d’en arriver à une telle option, rien n’est certain. Compte tenu de l’évolution du titre, les investisseurs ne semblent pas convaincus que le groupe aura réellement le choix. Nous avons également de plus en plus de doutes sur la capacité du groupe à éviter une augmentation de capital ou tout autre instrument dilutif à l’horizon des prochains mois.
Enfin, le départ du directeur des opérations Engineering & Industry (qui en résumé chapeautait la production et le “supply”) a été annoncé. Il sera remplacé par le directeur industriel. Bien que dans fréquent dans la vie d’une entreprise, ce départ ne constitue pas non plus une bonne nouvelle.
Globalement, nous estimons que les investisseurs ont besoin de davantage d’éléments concrets pour être pleinement convaincus des perspectives offertes par le groupe. Même si des progrès ont été réalisés vers la commercialisation de Zeneo, il faudra beaucoup de temps avant que cette dernière ne porte ses fruits, ce qui laisse entrevoir d’autres mauvaises nouvelles sur le front du financement. D’autant plus que Crossject a depuis longtemps eu du mal à respecter les délais. Même en tenant compte des fonds récoltés grâce à l’accord signé avec la BARDA (3,2mUS$ en 2023) et au lease-back de l’immobilier sur plusieurs années, un recours au financement externe devrait s’imposer en 2024, et ce d’autant plus si l’obtention de l’EUA devait prendre plus de temps que prévu. Pour rappel, elle était attendue pour fin 2023/début 2024 et l’horloge tourne.
IMPACT
A ce stade, nous n’allons pas ajuster nos estimations/modèle dans l’attente de la publication des résultats 2023. Néanmoins, nous doutons un peu plus concernant le calendrier des lancements de produits sur le marché américain. S’il est certain que la direction n’a pas toutes les cartes en main en la matière, nous ne pouvons pas ignorer la perspective d’un nouveau recours au financement externe. De fait, nous prévoyons de réviser à la baisse de nos estimations (notamment en raison de rentrées de fonds plus tardives qu’anticipées), ce qui pourrait/devrait peser sur notre objectif de cours.
|
Répondre
|
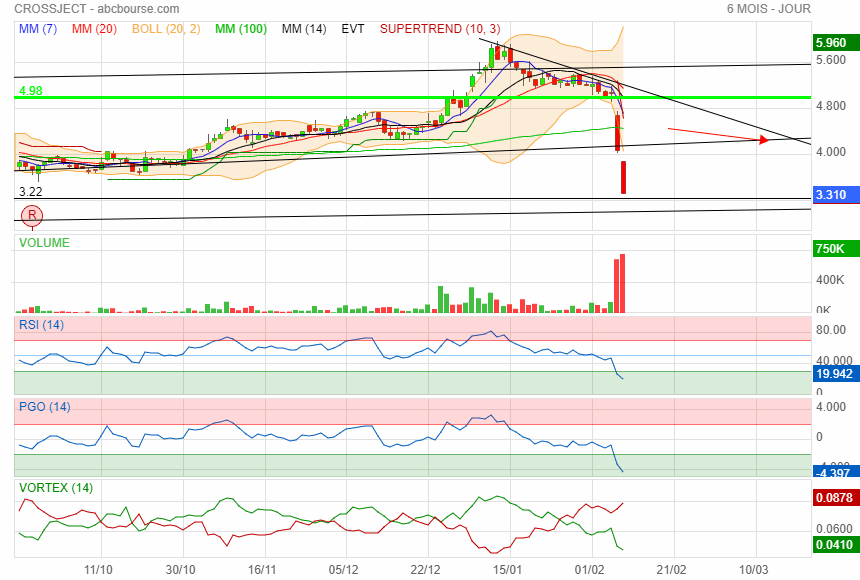
jamais attraper un couteau qui tombe !!!!
Prochain support 3.22
perso je viens dans reprendre
|
Répondre
|

 Suivez les marchés avec des outils de pros !
Suivez les marchés avec des outils de pros !