CROSSJECT - News - Reco - Page 8
Cours temps réel: 2,235 0,68%| Cours | Graphes | News | Analyses et conseils | Historiques | Vie du titre | Secteur | Forum |
Crossject : Tony Tipton chargé de déployer le remède anti-épilepsie aux Etats-Unis
Actualité publiée le 19/08/24 17:52
|
Répondre
|
les 2 sont pas loin !
|
Répondre
|
Crossject franchit une nouvelle étape clé dans la fabrication de ZEPIZURE®
Le 18 juillet 2024
Fabrication réussie d’un autre Lot Règlementaire de ZEPIZURE® sur le nouveau site de fabrication
Une étape importante qui complète les résultats satisfaisants obtenus avec les lots précédents dans le cadre des études de stabilité, et qui s'inscrit dans la continuité des données de fabrication positives générées depuis 2021
Une étape dans la fabrication qui contribuera au succès de la procédure d’urgence (EUA) de la FDA conformément au plan de marche
Dijon, France, le 18 juillet 2024, 07:30 CET -- Crossject (ISIN: FR0011716265; Euronext: ALCJ), société pharmaceutique de spécialités en phase avancée de développement réglementaire de ZEPIZURE®, traitement d’urgence dans la prise en charge des crises d’épilepsie basé sur l’auto-injecteur sans aiguille primé ZENEO®, annonce l'achèvement avec succès d'un nouveau lot règlementaire de ZEPIZURE® dans les installations qualifiées d'Eurofins. Eurofins est désigné comme le partenaire CDMO qui assurera les activités de remplissage et l’assemblage final pour les livraisons à la Biomedical Advanced Research and Development Authority (BARDA*) des États-Unis.
Cette étape fait suite à un lot précédent produit sur le même équipement de remplissage en décembre 2023, qui avait donné de bons résultats et fait partie du programme de fabrication de divers lots sur le site commercial, visant à confirmer notamment la durée de péremption de ZEPIZURE®. Ces nouvelles avancées sont en ligne avec les précédentes données de stabilité à long terme.
Les lots de fabrication sont des éléments essentiels du dossier qui sera soumis à la FDA en relation avec la demande d’autorisation de ZEPIZURE® dans le cadre de sa procédure d’urgence (EUA). Combinés à notre prochaine étude de bioéquivalence aux États-Unis, ils constitueront aussi une pièce centrale de nos futurs dossiers de demande d'autorisation de mise sur le marché (NDA) à partir de 2025.
L'achèvement de ce lot d'enregistrement ouvre maintenant la voie à la collecte de nouvelles données qui démontreront davantage la qualité des produits fabriqués avec le nouvel équipement et assureront son adéquation réglementaire à une large utilisation commerciale, débutant avec sa livraison au Strategic National Stockpile américain. Crossject anticipe ses prochaines étapes avec la FDA concernant l'autorisation selon la procédure d’urgence (EUA) de ZEPIZURE® dans l’état de mal épileptique pour le T1 2025.
Patrick Alexandre, CEO of Crossject a déclaré « Nous sommes très satisfaits des progrès réalisés dans la mise en place d'un nouveau partenaire CDMO, augmentant nos capacités de remplissage et d’assemblage final pour ZENEO®. La production réussie de ce nouveau lot réglementaire, ainsi que des lots précédents, témoigne du travail acharné et du dévouement des deux équipes au cours des 18 derniers mois. Au-delà de ZEPIZURE®, ces succès dans notre processus de fabrication, notre dossier réglementaire et l’expansion de nos capacités industrielles ont une vraie valeur stratégique pour Crossject. Ils constituent une première étape concluante dans le plus large déploiement de notre technologie ZENEO® dans l'épilepsie et dans les autres indications de notre pipeline.”
|
Répondre
|
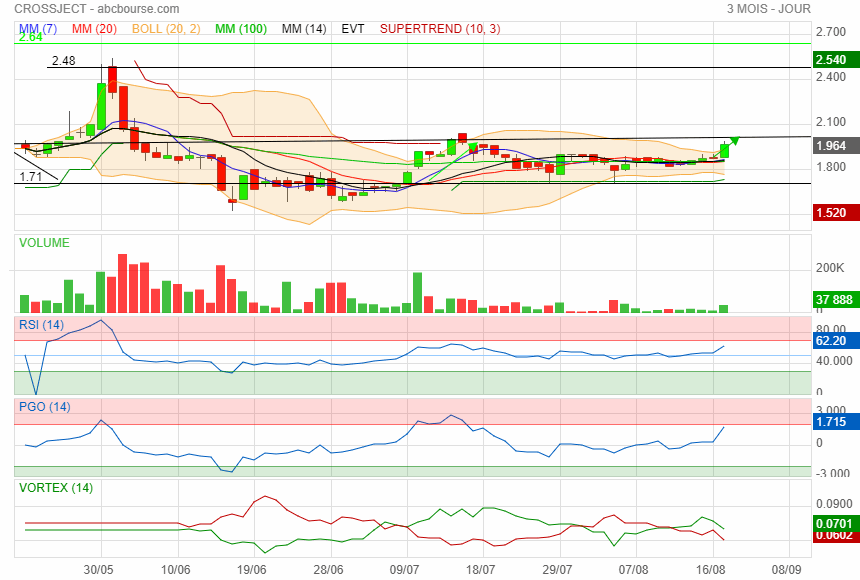
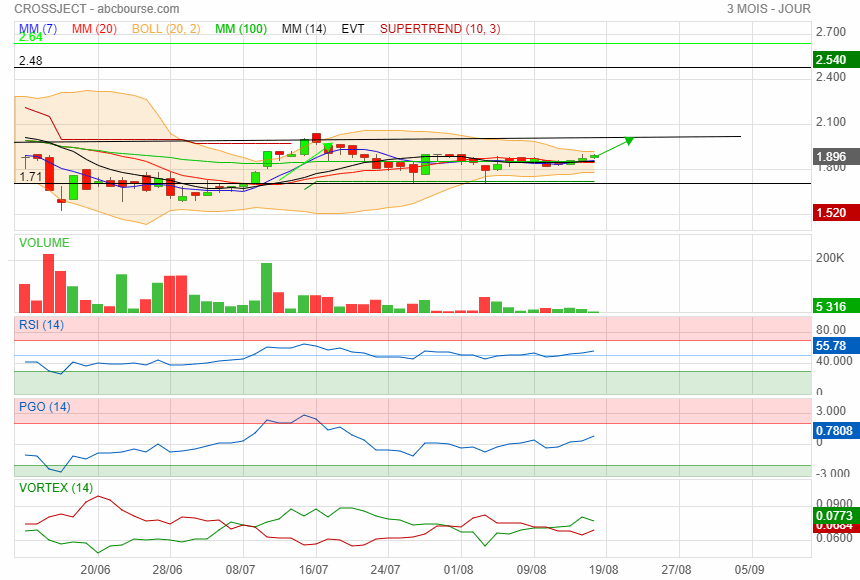
Graphique a chaque fois qu' elle est repartie du support de 1.71 elle avait fait un beau parcours perso j ai mis une sacoche de plus à la mule.
|
Répondre
|
@philiberts,
Merci beaucoup !
Une réaction du cours un peu timide (?) dans des volumes supérieurs à la moyenne ...
|
Répondre
|
|
Répondre
|
Bonjour,
@philiberts
Merci de cette info !
Pourriez-vous nous en préciser la source ?
Merci d'avance !
|
Répondre
|
Crossject obtient 6,9 millions d'euros de financement public dans le cadre du plan France 2030, pour accélérer le développement de ZENEO® Adrénaline
Le 10 juillet 2024 à 07:30
Crossject repasse au dessus de son support de 1.71
direction 1.98
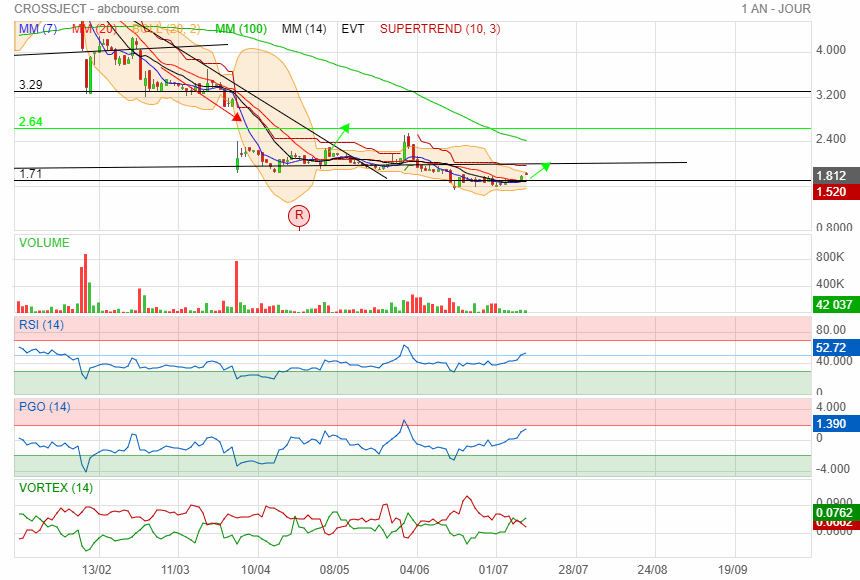
|
Répondre
|
Crossject met en perspective le potentiel de ZEPIZURE® à la lumière de l’étude de référence RAMPART et de sa propre étude de bioéquivalence récemment publiée.
26 juin 2024
Dijon, France 26 Juin 2024 — Crossject (ISIN: FR0011716265; Euronext: ALCJ), société pharmaceutique de spécialités en phase avancée de développement clinique et réglementaire de ZEPIZURE®, traitement d’urgence dans la prise en charge des crises épileptiques basé sur l’auto-injecteur sans aiguille primé ZENEO®, fournit des perspectives supplémentaires et cliniquement significatives sur ZEPIZURE® à la lumière des résultats de son étude de bioéquivalence récemment publiée, et des conclusions et indications des auteurs de l’étude RAMPART1 (Rapid Anticonvulsant Medication Prior to ARrival Trial), un essai clinique randomisé en double aveugle comparant l’efficacité du midazolam IM par rapport au lorazepam IV dans le traitement préhospitalier du status epilepticus par les ambulanciers. Le status epilepticus ou état de mal épileptique se définit comme une crise d’épilepsie qui dure plus de 5 minutes.
Sans équivoque, RAMPART a établi le midazolam IM comme la norme de soins dans la gestion d’urgence préhospitalière du status epilepticus en démontrant sa non-infériorité par rapport au lorazepam IV, critère d’évaluation principal de l’étude. De surcroît, le midazolam IM a démontré une supériorité statistiquement significative (valeur p<0,001) sur le pourcentage de patients arrivant sans crise à l’hôpital, qui était 10 % plus élevé avec l’utilisation du midazolam IM (329 sur 448 patients, soit 73.4% contre 63.4% dans le bras de 445 patients recevant le lorazepam IV). Ces résultats soulignent l’importance de la rapidité d’administration du midazolam IM, un médicament facile à stocker et prêt à l’emploi pour le personnel paramédical, des caractéristiques qui ont probablement joué un rôle essentiel dans l’efficacité du contrôle des crises au moment de l’arrivée aux urgences. RAMPART est l’une des plus vastes études jamais réalisées dans le domaine des urgences. Elle a impliqué 4 314 personnels paramédicaux, 33 unités de SAMU (Emergency Medical Services) et 79 services d’urgences hospitaliers à travers les États-Unis. Cette étude fut soutenue par le National Institute of Health (NIH) et par la Biomedical Advanced Research and Development Authority (BARDA). La publication de l’étude RAMPART peut être trouvé dans le lien suivant.
L’étude de Crossject, récemment publiée dans la revue Neurology and Therapy, a fait positivement écho aux bénéfices observés dans RAMPART, et est cohérente avec certains arguments avancés par les auteurs de l’étude RAMPART. Dans l’étude de Crossject, ZEPIZURE® s’est avéré équivalent à l’injection IM avec une seringue équipée d’une aiguille de 30 mm (Dormicum®), et les résultats ont aussi indiqué une variabilité deux fois moindre par rapport à celle habituellement observée pour des voies d’administration telles que l’intranasal.
Avec une certaine vision et sur la base de leur expérience d’alors, les auteurs de RAMPART avaient souligné un certain nombre de problématiques concernant les solutions intranasales dans les crises d’épilepsie en général, et indiqué la probable domination de la voie IM à l’avenir. Aujourd’hui, aucune solution intranasale n’est approuvée pour la prise en charge du status epilepticus. Selon les auteurs de l’étude RAMPART, les premières minutes ont été des facteurs déterminants dans la supériorité de 10 % du midazolam IM, injecté manuellement depuis un flacon, pour atteindre des résultats cliniques positifs avant l’arrivée aux urgences. ZEPIZURE®, injection ultra-rapide en deux étapes, s’inscrit fortement dans la réalité pratique de l’interventionnel, et est susceptible d’améliorer encore la rapidité d’action des professionnels de santé, ainsi que la fiabilité de l’injection d’une dose complète de midazolam. Dans l’étude de Crossject, ZEPIZURE® a en outre amélioré l’absorption du midazolam au cours des toutes premières minutes suivant l’injection, ce qui pourrait venir de l’injection sans aiguille en 50 millisecondes par rapport à l’IM manuelle, et suggérer que le traitement des crises pourrait être efficace encore plus tôt.
Patrick Alexandre, Président du Directoire de Crossject ajoute : “Au-delà de la porte d’entrée réglementaire et commerciale 505(b)(2) pour ZEPIZURE® dans l’arsenal des professionnels de santé pour le status epilepticus, comme outil potentiellement le plus rapide d’utiliser et avec la plus faible variabilité pour l’administration d’une dose complète de midazolam avant l’arrivée à l’hôpital, notre produit présente un potentiel supplémentaire. L’application en deux étapes de ZEPIZURE®, rapide et facile, devrait potentiellement nécessiter une formation limitée par rapport aux injectables traditionnels, et la constance dans l’administration d’une dose efficace devrait lui conférer un avantage clé. ZEPIZURE® est donc voué à fournir à tous les patients, ainsi qu’à leurs proches ou soignants, la solution professionnelle de soins préhospitaliers de référence, à tout moment et en tout lieu. Notre équipe en Europe et aux Etats-Unis met actuellement en œuvre notre stratégie de développement afin de concrétiser ces vastes perspectives pour faire évoluer ZEPIZURE® d’une amélioration de productivité pour les professionnels de santé vers une solution à fort impact pour tous les patients et familles exposés à un large éventail de crises d’épilepsie.”
|
Répondre
|
Prochain support 1.25
faudrait repasser au dessus de 1.70 mais vite vite !!
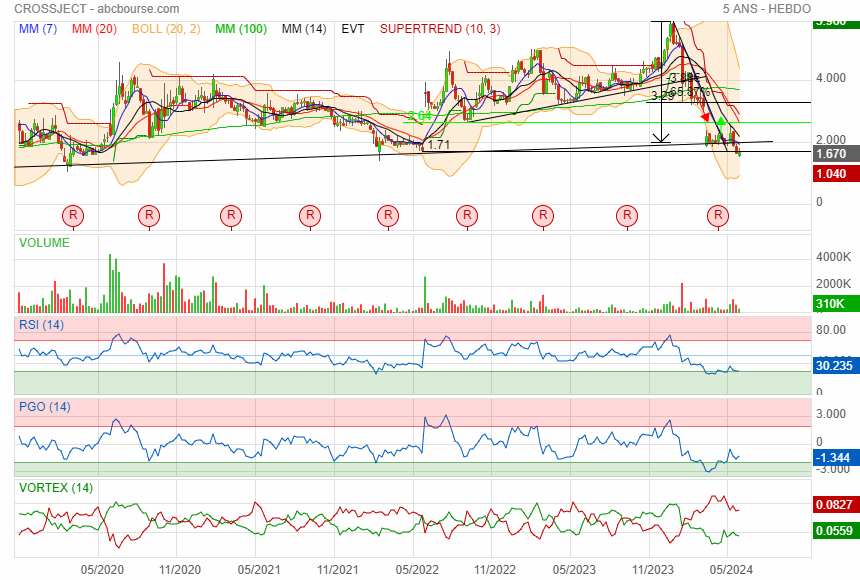
|
Répondre
|
Jolie rebond c'est monté bien haut
AK terminée ce soir
C'est prochains jour certains voudrons prendre leurs bénéfices
à suivre !
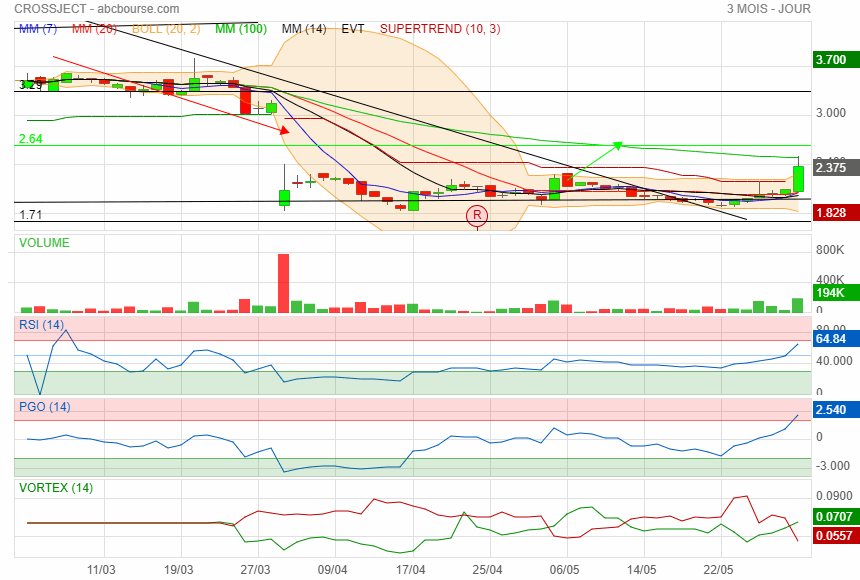
|
Répondre
|
Crossject annonce la publication de données cliniques sur ZEPIZURE® dans Neurology and Therapy
Le 30 mai 2024
L’étude clinique réalisée en 2022 est maintenant publiée dans la revue à comité de lecture Neurology and Therapy
Plus de details sur la bioéquivalence démontrée par rapport au médicament européen Dormicum®
Efficacité rapide attendue grâce à une concentration sanguine précoce de midazolam avec ZEPIZURE®
Faible variabilité confirmée, un avantage clé par rapport à d'autres formes d'administration telles que l'intra-nasal
Dijon, France, 30 mai, 2024 -10:30 CET - Crossject (ISIN: FR0011716265; Euronext: ALCJ), société pharmaceutique de spécialités en phase avancée de développement réglementaire de ZEPIZURE®, traitement d’urgence dans la prise en charge des crises d’épilepsie basé sur l’autoinjecteur sans aiguille primé ZENEO®, annonce la publication de données cliniques sur ZENEO® dans la revue à comité de lecture Neurology and Therapy.
Les convulsions nécessitent un traitement urgent lorsqu'elles durent plus de 5 minutes et, lorsqu'elles se prolongent, peuvent entraîner des lésions cérébrales, un coma et finalement la mort. Le midazolam injecté dans le muscle est devenu le traitement de première intention pour les convulsions prolongées. ZEPIZURE®, basé sur l'auto-injecteur ZENEO® et précédemment connu sous le nom de ZENEO® Midazolam, permet une administration sans aiguille du midazolam avec des avantages significatifs associés.
L'article publié présente les résultats complets d'une étude clinique menée en 2022, démontrant que ZENEO® permet d'injecter du midazolam par voie intramusculaire, sur la peau nue ou à travers les vêtements, de la même manière qu'une seringue équipée d'une aiguille de 30 mm (Dormicum®), et avec une variabilité deux fois plus faible par rapport à celle habituellement observée pour les voies d'administration telles que l'intranasale. De plus, ZEPIZURE® a amélioré l'absorption du midazolam au cours des premières minutes suivant l'injection, ce qui suggère que le traitement des convulsions peut être efficace plus rapidement grâce au ZENEO®. Le profil de sécurité, le niveau de douleur et la sédation étaient comparables à ceux de l'injection intramusculaire par seringue. La concentration sanguine maximale atteinte avec ZEPIZURE® n'est pas supérieure à celle de Dormicum®, ce qui est un bon indicateur en termes de sécurité.
« L'auto-injecteur sans aiguille ZENEO® est un dispositif innovant, prérempli, à dose unique, prêt à l'emploi en deux étapes, qui pourrait devenir le meilleur dispositif de sa catégorie pour l'administration intramusculaire en cas d'urgence. La délivrance de la dose complète de 10 mg de manière sécurisée, avec une faible variabilité et dans des conditions pratiques, est un avantage décisif en situation d'urgence », a déclaré Olivier Lacombe, PhD, Directeur du Développement Pharmaceutique de Crossject et auteur principal de l’article.
L'étude croisée et randomisée en 4 périodes a été menée sur 40 sujets sains, avec une diversité de genre, d'ethnie et d'indice de masse corporelle (ClinicalTrials.gov NCT05026567). Les données rapportées en novembre 2022 ont montré que l'objectif principal de l'essai a été atteint, avec l'évaluation de la biodisponibilité relative du midazolam après injection avec l'auto-injecteur sans aiguille ZENEO® (10 mg de midazolam dans 0,625 mL). Cela a été comparé à l'injection de Dormicum® (10 mg de midazolam dans 2 mL) par une seringue conventionnelle avec une aiguille de 30 mm, dans la cuisse sur peau nue.
« Les résultats cliniques détaillés publiés aujourd'hui dans Neurology and Therapy sur ZEPIZURE® sont prometteurs, car ils soulignent sa capacité à administrer rapidement et de façon fiable des médicaments vitaux », a déclaré Patrick Alexandre, PDG de Crossject.
|
Répondre
|
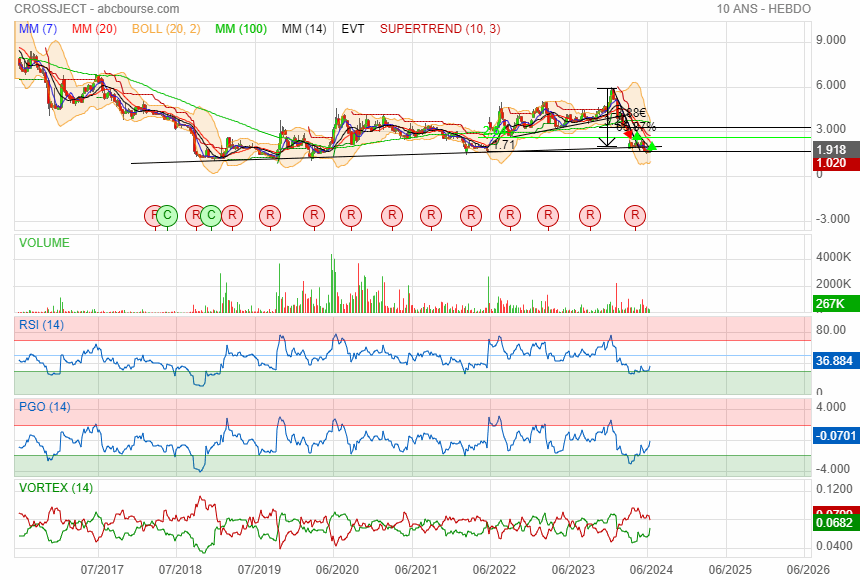
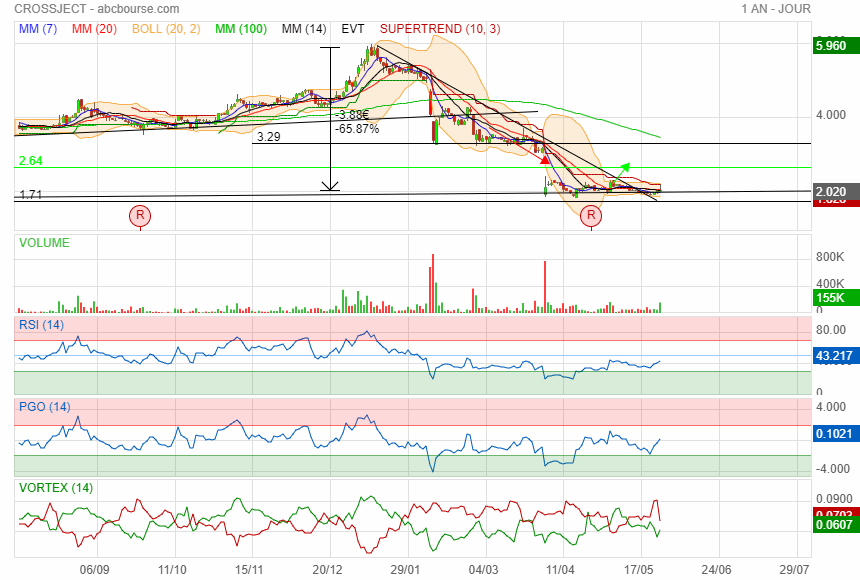
Sur 10 ans
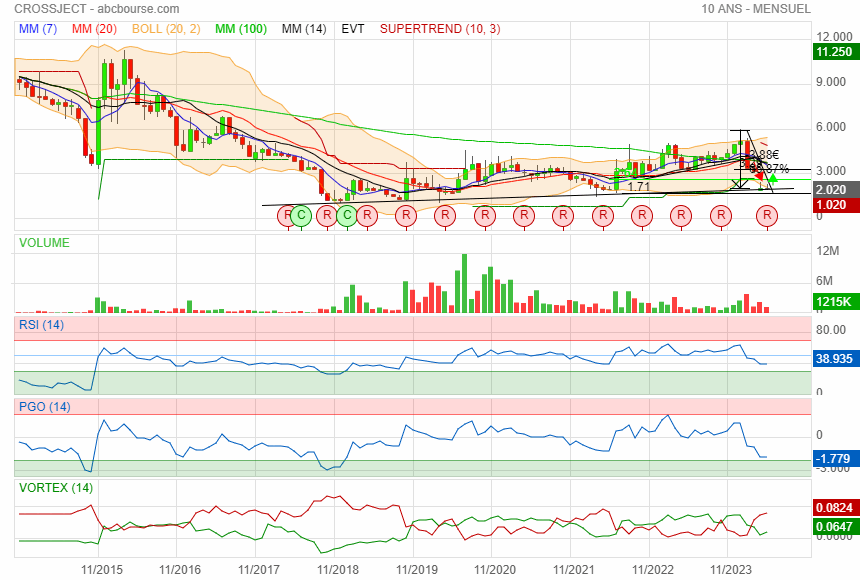
|
Répondre
|
Retour sur 1€ mais non mais non......
retour 6 ans en arrière en 2018 pour 1 an de retard !!
avec un cours de 2 € après avoir perdu 2/3 de sa valeur en si peu de temps
passer de 2 à 1 encore moins 50% et le plus bas historique est de 1.02
en ce moment depuis 3 mois accumulation dans la zone des 2 €
elle est mure pour refermer le gap vers 3 €
|
Répondre
|
Crossject a annoncé le 30 avril le lancement d'une augmentation de capital avec maintien du DPS d'un montant d'environ 8 ME.
Le prix de souscription des Actions Nouvelles est de 1,848E. 17 DPS permettront de souscrire à 2 actions nouvelles.
' L'opération est sécurisée par Gemme Venture, l'actionnaire de référence, via un engagement de souscription à titre irréductible de 1,96mE (à hauteur de ses droits) et d'une garantie complémentaire pour couvrir les 75% de l'opération soit 6mE, tout en se réservant la possibilité de couvrir 100% du montant à souscrire soit 8mE. La majorité des fonds serviront au développement de ZEPIZURE ' indique Invest Securities.
La période de souscription est fixée du 16 au 30 mai inclus. La fin de la période de négociation des DPS est fixée le 28 mai. CP de résultat du placement le 4 juin.
Allinvest agit en tant que PSI et Teneur de Livre.
|
Répondre
|
Dans ce numéro hors-série du Journal des biotechs, Patrick Alexandre fait un point de situation très complet sur Crossject.
|
Répondre
|
Potentiellement un rebond avant les résultats de l AK, vers 2.4€ et rechute... À l'issue je la vois bien prendre la direction des plus bas à 1€, pas de gros changements sur le fond, la commercialisation ne se fera pas avant 2025, et la capitalisation actuelle est trop importante compte tenu de l'incertitude.. juste un avis
|
Répondre
|
Crossject s'envole de 10%, à la suite de l'extension de la couverture géographique de son accord de commercialisation de décembre 2023 avec un partenaire non divulgué pour son traitement d'urgence des crises d'épilepsie, Zepizure.
Grâce à cette extension, le contrat couvre désormais un total de 11 pays européens. Pour rappel, Crossject recevra des paiements d'étape pour jusqu'à un million d'euros, dès l'obtention des autorisations de mise sur le marché dans les territoires concernés.
Crossject vendra Zepizure à son partenaire avec un coefficient correspondant à une part de la marge brute. La société couvre les frais liés au développement réglementaire et détient les autorisations de mise sur le marché potentielles.
|
Répondre
|
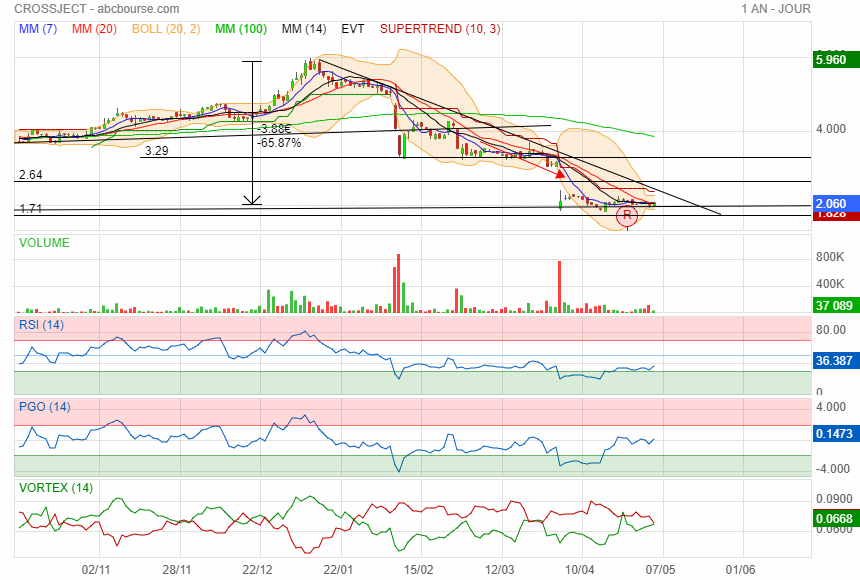
Consolidation à ce niveau, plusieurs mini rebond vers 2
plusieurs indicateurs se redressent
elle se rapproche de l' oblique
peut être le bon moment dans reprendre a vous de voir
perso c est ce que j ai fait j ai commencé par une petite ligne.
|
Répondre
|
Crossject signe une extension géographique de l'accord de commercialisation de ZEPIZURE® en Europe
Le 02 mai 2024 à 17:30
Le contrat couvre désormais un total de 11 pays européens
Crossject recevra des paiements d’étape pour un montant total pouvant aller jusqu’à un million d’euros, dès l’obtention des autorisations de mise sur le marché
Crossject vendra ZEPIZURE® à son partenaire avec un coefficient correspondant à une part de la marge brute
Dijon, France, 02 mai 2024 – 17:30 CET – Crossject (ISIN : FR0011716265 ; Euronext : ALCJ), une société pharmaceutique spécialisée qui développe des auto-injecteurs sans aiguille dédiés aux situations d'urgence, annonce l’extension de la couverture géographique de son accord de commercialisation du 22 décembre 2023 avec un partenaire non divulgué pour son traitement d'urgence innovant dans la prise en charge des crises d'épilepsie, ZEPIZURE®, précédemment connu sous le nom de ZENEO® Midazolam.
Grâce à cette extension, le contrat couvre désormais un total de 11 pays européens.
Pour rappel, selon les dispositions de l’accord, Crossject recevra des paiements d’étape pour un montant total pouvant aller jusqu’à un million d’euros, dès l’obtention des autorisations de mise sur le marché dans les territoires concernés. Crossject vendra ZEPIZURE® à son partenaire avec un coefficient correspondant à une part de la marge brute (ventes nettes réalisées par le partenaire dans les marchés - coût de production).
Crossject couvre les frais liés au développement réglementaire et détient les autorisations de mise sur le marché potentielles, tandis que son partenaire a la responsabilité et le contrôle de tous les frais commerciaux.
En juin 2019, Crossject avait signé un accord pour l'Allemagne, qui a été résilié sans réclamation.
|
Répondre
|

 Suivez les marchés avec des outils de pros !
Suivez les marchés avec des outils de pros !