CROSSJECT - News - Reco - Page 3
Cours temps réel: 2,235 0,68%| Cours | Graphes | News | Analyses et conseils | Historiques | Vie du titre | Secteur | Forum |
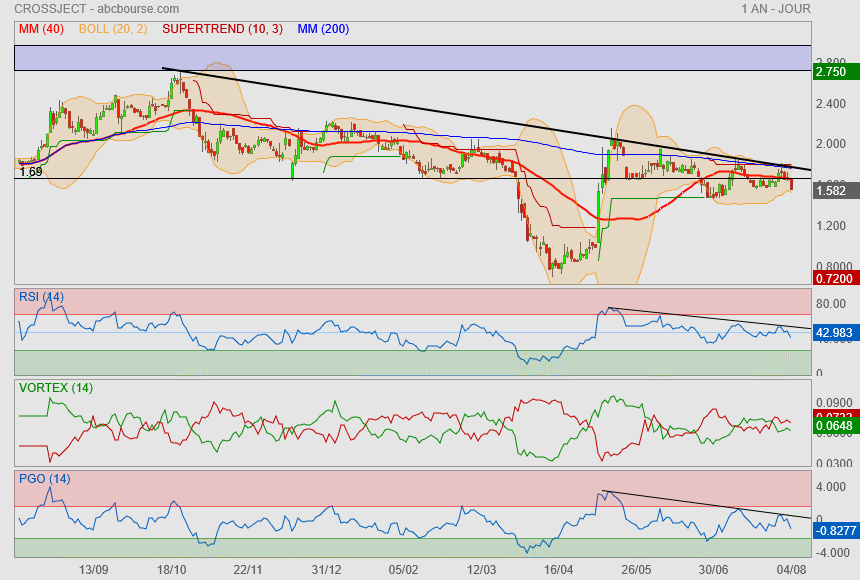
Bonne confirmation de ce que je disais sur mon post du 28/07..
tant qu'on ne franchira pas cette oblique noire ==> rien à espérer !
|
Répondre
|
Elle va reprendre de la hauteur ces prochaines semaines..
Entre la Barda et la D.O.D .Elle risque de faire un jolie bond.
Message complété le 14/08/2025 15:30:00 par son auteur.
çà fait plaisir de revoir quelques bougies vertes !!!
|
Répondre
|
Voici des infos et avis trouvés ce jour sur un autre forum :
31 juil. 2025
1. Position actuelle : valorisation encore modeste
•Malgré le contrat BARDA (60 M$ + options jusqu’à 155 M$), la valorisation actuelle est de seulement 88 M€, ce qui reste très bas comparé au potentiel réel.
•En biotech, une société avec un produit autorisé et un marché sécurisé par contrat étatique US se valorise souvent entre 300 et 500 M€.
2. L’EUA change la donne
•L’obtention de l’EUA (Emergency Use Authorization) est le véritable feu vert opérationnel : cela permet à Crossject de livrer rapidement à la BARDA.
•Ce serait perçu par le marché comme :
•Une validation réglementaire de la FDA,
•Un accès direct au chiffre d’affaires,
•Une réduction massive du risque perçu.
3. Réévaluation attendue : x3 à x5 sur la capitalisation
•En cas d’annonce d’EUA + premières livraisons BARDA :
•Une valorisation de 300 à 500 M€ devient raisonnable à horizon quelques mois.
•Cela représenterait un cours cible de 5,80 € à 9,60 € environ.
??? A suivre... 🧐🔎
|
Répondre
|
C'est bientôt son heure.
|
Répondre
|
Paiement de la Barda de 10 Millions.
|
Répondre
|
Pas de chandelle avant la clôture 😨
|
Répondre
|
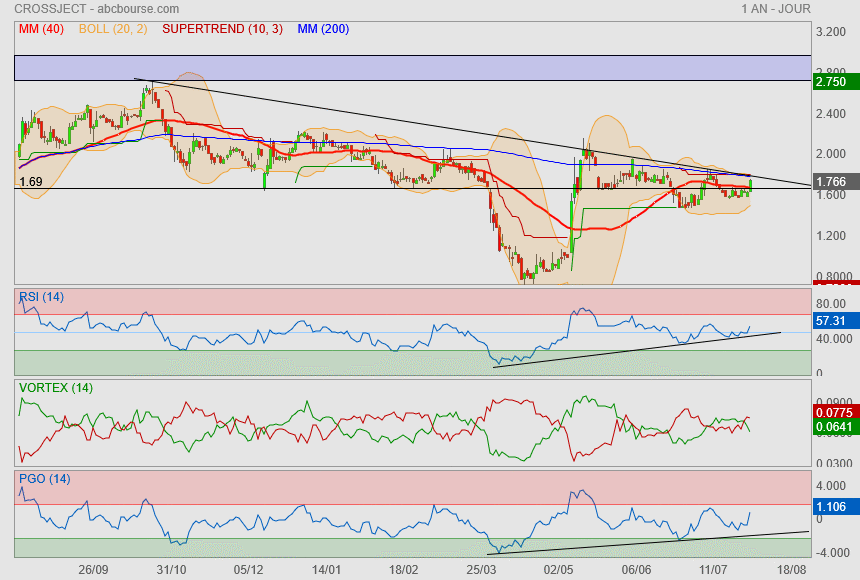
le changement c'est maintenant ?
bein non.. pas encore ! 
|
Répondre
|
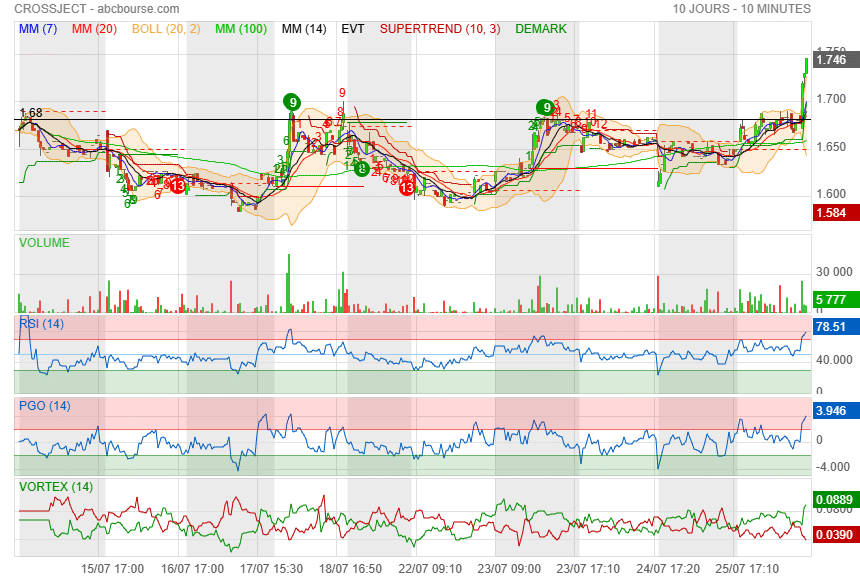
c est maintenant !
|
Répondre
|
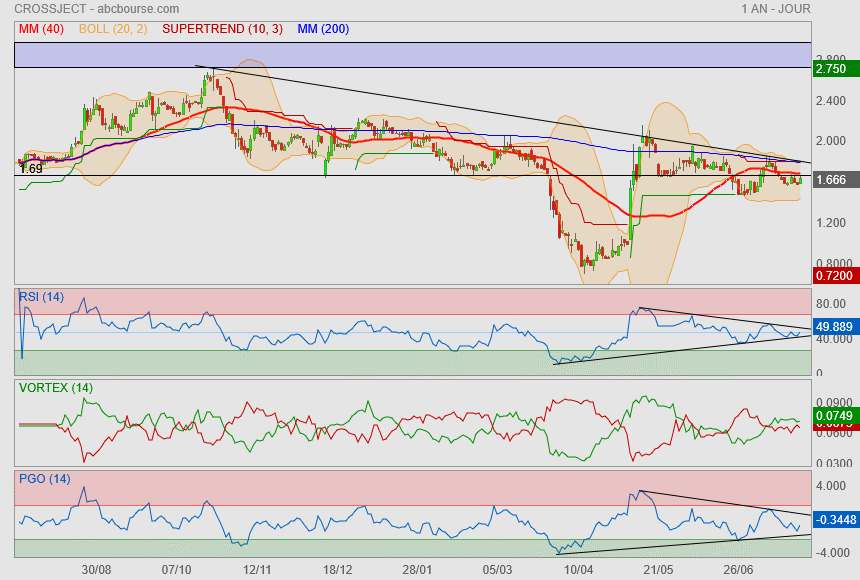
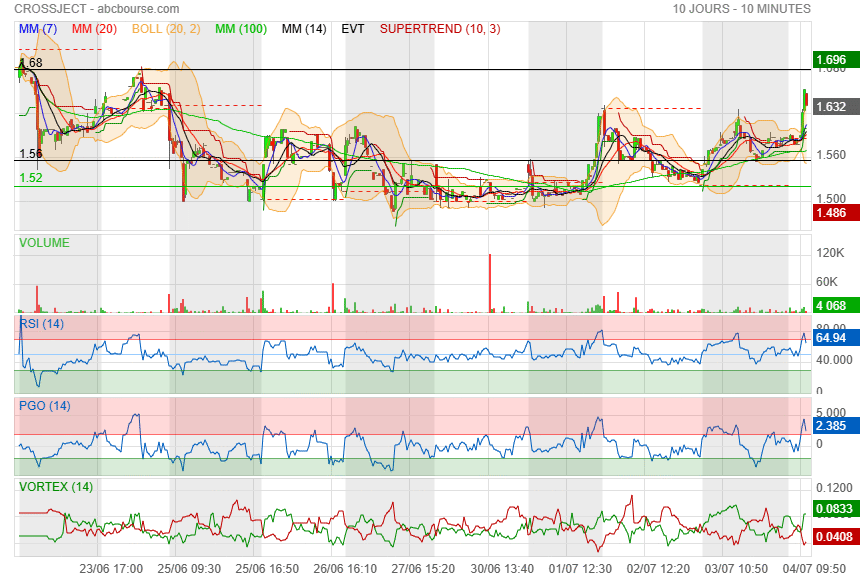
A la vue du Rsi, on est peut être à l'aube d'une nouvelle phase prochaine..
Il faut repasser la Mm40 et les 1.69 pour respirer plus sereinement ! 
|
Répondre
|
D'ici peu il ni y'aura plus de place pour rentrer.
Je rentre de nouveau sur le titre avec de belles nouvelles en perspective dans les jours et semaines à venir.
Actionnaire.
|
Répondre
|
C'est bon la il y a suffisamment de place pour que ca passe.
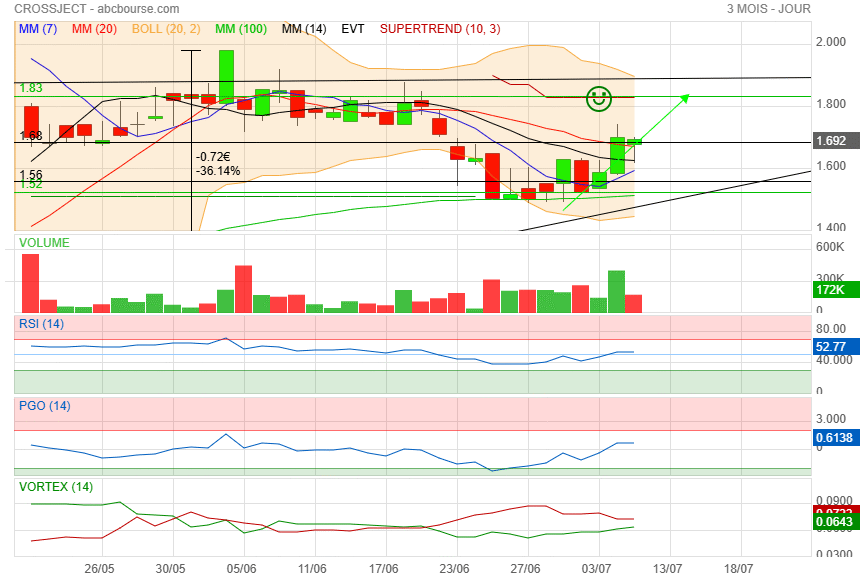
|
Répondre
|
Zut
et ce n'est pas possible de le déplacer ailleurs ?
|
Répondre
|
ca ne peut pas monter plus haut y a le petit bonhomme vert qui bloque la bougie !
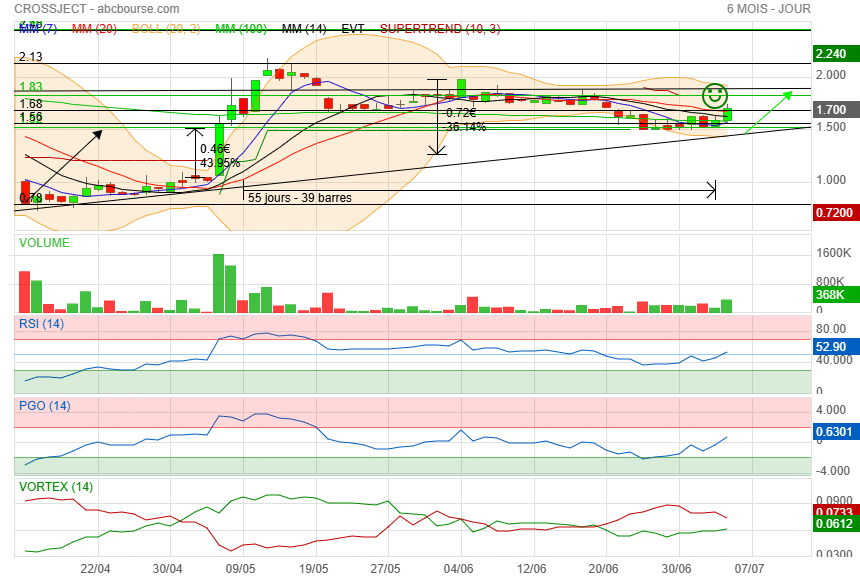
|
Répondre
|
le bouchon vient de sauter direction 1.82
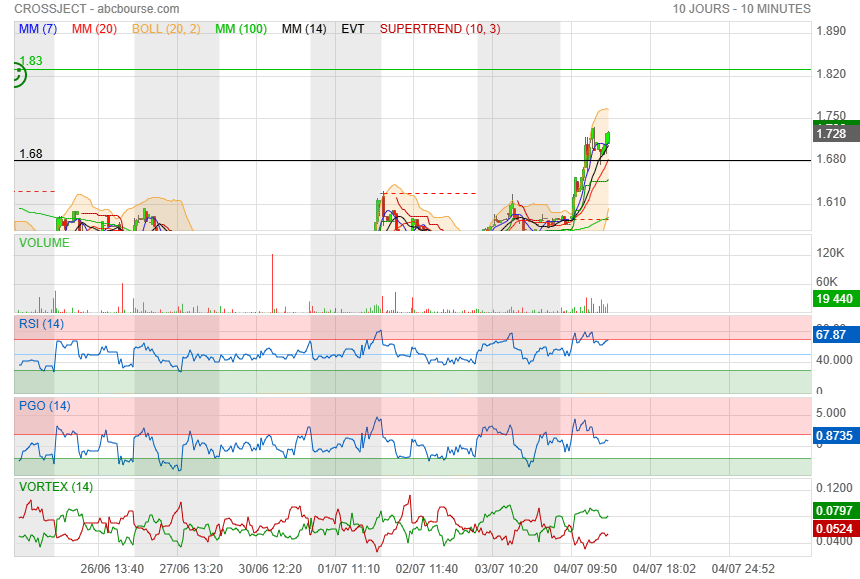
|
Répondre
|
ça m'embête qu'on n'est pas tenu les 1.69 et en prime, qu'on soit passé sous la Mm40.
Côté indicateurs, on va dire que ça reste favorable à un peu de hausse
mais côté prix, y a du boulot :
1) oblique
2) Mm40
3) supertrend
4) Mm200
5) Boll+
Aller zou......... au boulot !!! 
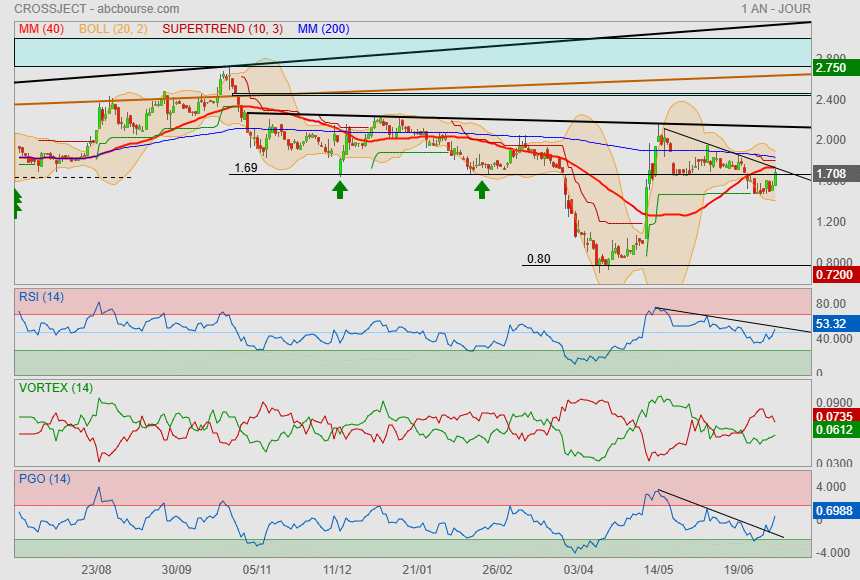
|
Répondre
|
première résistance sur 1.68
|
Répondre
|
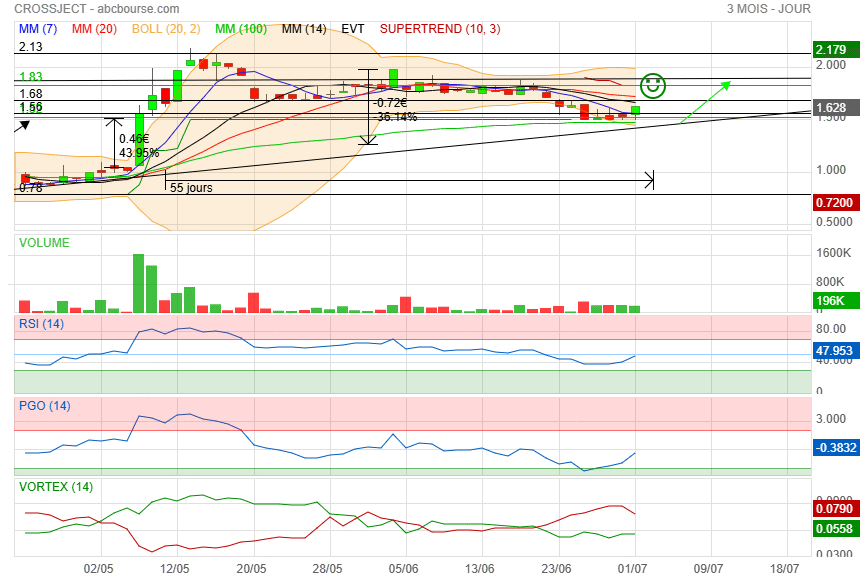
Belle clôture et pourquoi pas un retour sur 1.90 pour la fin de la semaine.
|
Répondre
|
Invest Securities repasse à achat
Publié le 25/06/2025 à 10:03
Invest Securities fait repasser son opinion sur Crossject de 'souscrire' à 'achat' avec un objectif de cours ajusté de 3,4 à 3,3 euros, après le vif succès de son augmentation de capital avec une demande de 1,84 fois par rapport à l'offre initiale.
Permettant une levée totale de 5,7 millions d'euros après exercice de la clause d'extension, cette opération permet d'allonger la visibilité jusqu'à fin 2025, en anticipant des paiements de la BARDA au troisième trimestre, selon l'analyste.
Ce dernier souligne en outre que 'cette levée est réalisée en amont d'un newsflow capital pour la société avec l'approbation EUA de Zepizure attendue sur le troisième trimestre permettant les premières livraisons BARDA'.
|
Répondre
|
CROSSJECT annonce le vif succès de son augmentation de capital
Publié le 24/06/2025 à 19:00
* Opération portée à plus de 5,7 millions d’euros suite à l’exercice intégral de la clause d’extension.
* Demande totale de plus de 9 millions d’euros, soit un taux de sursouscription de 1.84x.
* Soutien de Gemmes Venture et entrée au capital de Vatel Capital.
Dijon, France 24 juin 2025 (19h00 CET) -- CROSSJECT (ISIN: FR0011716265; Euronext: ALCJ), la société pharmaceutique de spécialités en phase avancée de développement clinique et réglementaire de ZEPIZURE®, son traitement d’urgence dans la prise en charge des crises épileptiques basé sur l’auto-injecteur sans aiguille primé ZENEO®, annonce le succès de son augmentation de capital avec maintien du droit préférentiel de souscription (« DPS »), pour un montant brut de 5 725 479,20 euros après exercice intégral de la clause d’extension et pour un montant net d’environ 5 458 093.69 euros (l’ « Offre »).
Ce financement est une étape importante dans les phases finales d’enregistrement de ZEPIZURE® et la poursuite des étapes de production commerciale initiale. L’opération s’est faite à un prix de souscription de 1,40 euro, soit une décote de 22,6% par rapport au cours de clôture du 3 juin 2025.
Patrick ALEXANDRE, Président du Directoire, souligne : « Nous remercions vivement nos actionnaires pour leurs souscriptions et la demande qui a excédé de presque 100% le montant que nous avions initialement envisagé. Nous remercions en particulier Gemmes Venture qui a permis l'entrée des fonds gérés par Vatel Capital. Nous abordons la dernière ligne droite de l'histoire de ZEPIZURE® avec confiance, en ligne avec nos communications de mai et en phase avec le process géré par notre partenaire américain, et avec la sécurité financière nécessaire à sa pré-commercialisation, »
|
Répondre
|
moi je vois plutot une ETEi 
|
Répondre
|

 Suivez les marchés avec des outils de pros !
Suivez les marchés avec des outils de pros !