CROSSJECT - News - Reco - Page 6
Cours temps réel: 2,235 0,68%| Cours | Graphes | News | Analyses et conseils | Historiques | Vie du titre | Secteur | Forum |
Bonjour,
@Ptitchat72
Oui, des OCA et une dépendance vis à vis des USA (le BARDA) qui ne me semble pas de bon augure par les temps qui courent ...
|
Répondre
|
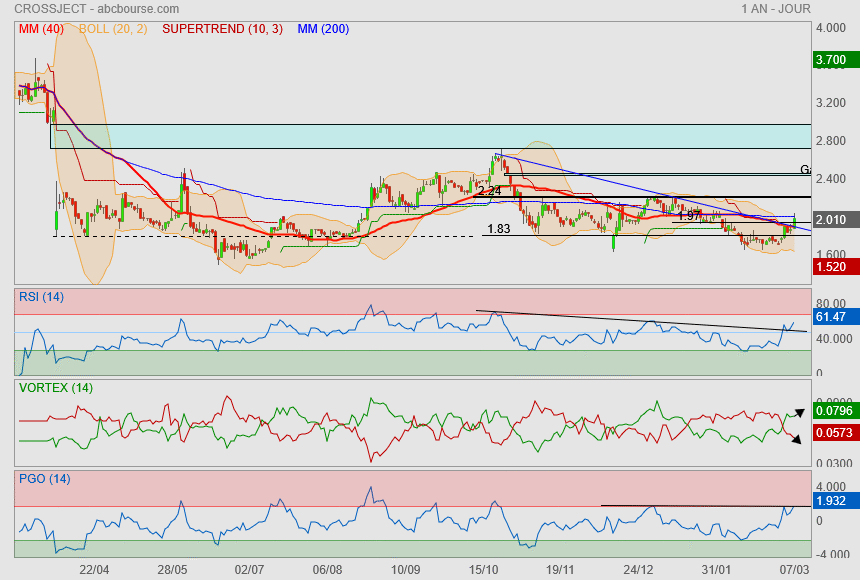
Ça avance dans le bon sens..
on passe l'oblique bleue et test la Mm200.
Cible potentielle 2.24 voir le gap qui se trouve au dessus ! <img alt="" src="/5/ic5.gif">
PS : attention c'est de l'ultra spéculatif
il y a des OCA là dessus !
Projet : https://www.abcbourse.com/marches/crossject-un-calendrier-de-forte-creation-de-valeur-en-2025-p-alexandre-pd_651500
|
Répondre
|
Au moment où l'Europe met tous les moyens sur sa défense, Crossject pourrait il devenir "incontournable" dans le secteur de la santé ?
A suivre ... 🧐🔎👀
|
Répondre
|
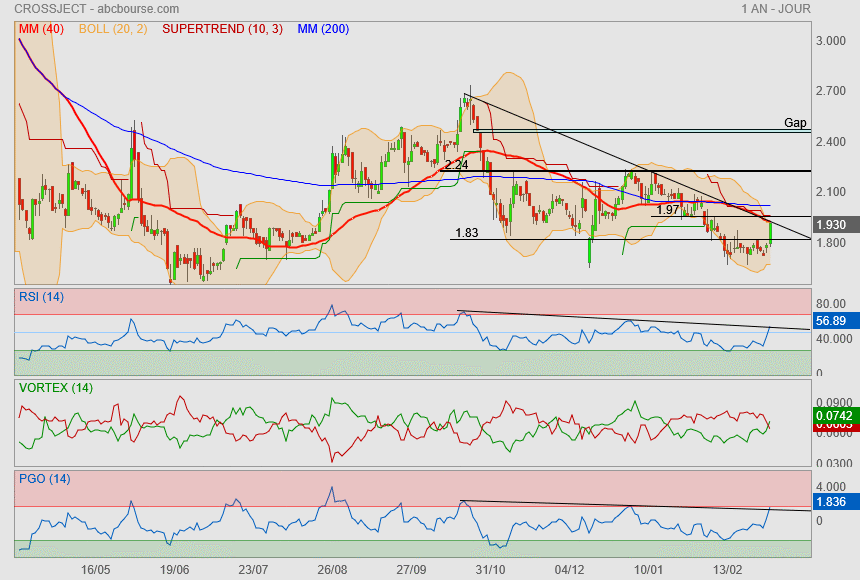
Très intéressant ce qui est en train de se jouer dorénavant.
6 résistances au dessus de la tête :
Mm40 + oblique
supertrend + Boll+ + résistance
Mm200
Si ça passe, c'est direct 2.24
puis la fermeture du gap si y a plus d'affinités 
A noter le double creux sur indicateurs !
|
Répondre
|
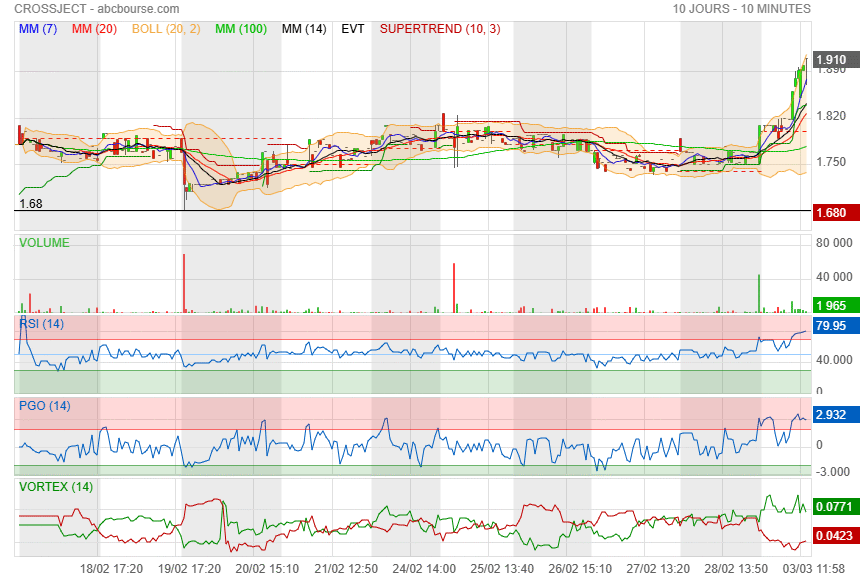
Vendredi a la clôture première alerte
et la on dirait bien que c est parti
|
Répondre
|
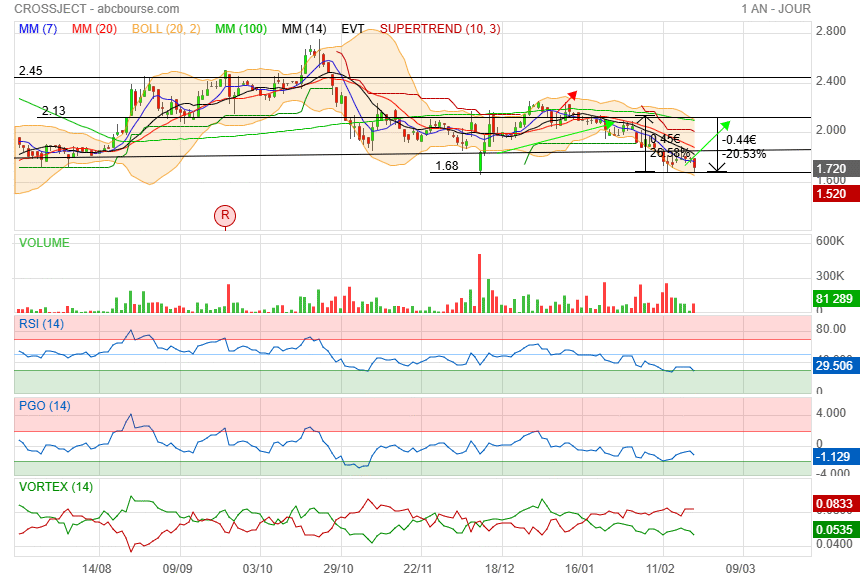
A force de taper su le support de 1.68 ca risque de casser !
Toujours actionnaire pour l instant
|
Répondre
|
1.68 touché
les indicateurs se redressent
A suivre
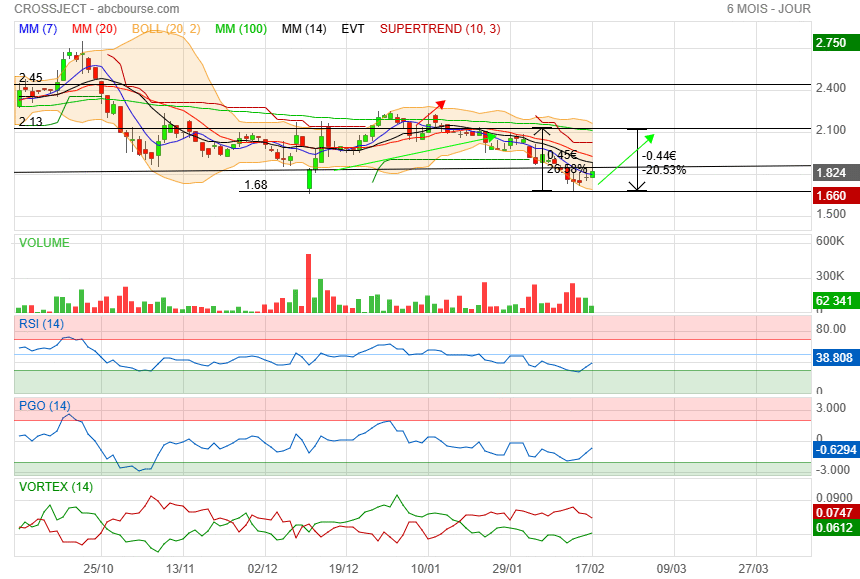
|
Répondre
|
Direction support 1.68
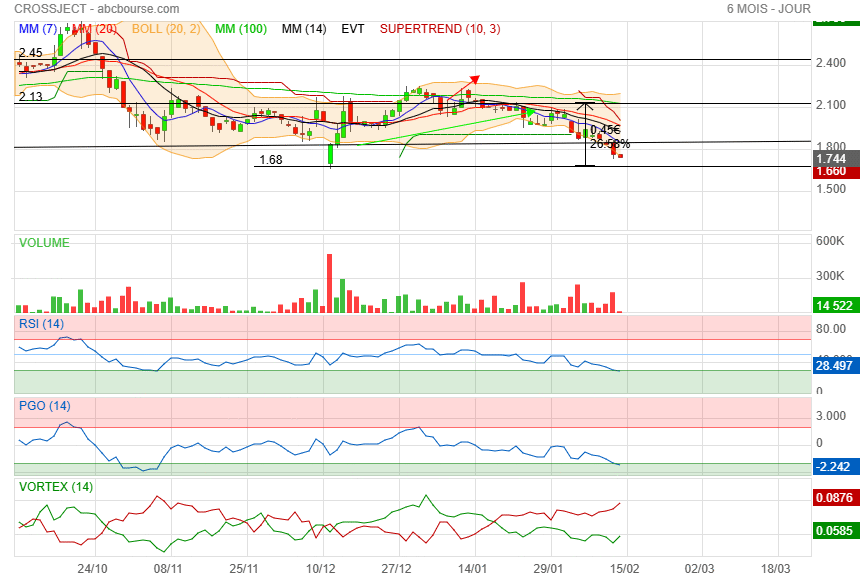
|
Répondre
|
Crossject annonce le renouvellement de Patrick Alexandre et Isabelle Liebschutz dans leurs fonctions de membres d’un nouveau Directoire ressérré
Le 12 février 2025
Crossject (ISIN: FR0011716265; Euronext Growth : ALCJ), société pharmaceutique spécialisée dans le développement des médicaments exploitant son auto-injecteur sans aiguilles ZENEO®, une technologie unique et récompensée qui permet d’administrer des médicaments vitaux dans des situations d’urgence, annonce que le Directoire sera composé à compter du 17 février prochain de Patrick Alexandre, en qualité de Président et d’Isabelle Liebschutz, en tant que Directeur Qualité et Règlementaire et Pharmacien Responsable de Crossject. Leurs mandats ont été renouvelés par le Conseil de surveillance tenu ce jour pour une durée de 4 ans. Le mandat d’Olivier Giré n’a pas été renouvelé compte-tenu de son départ prochain de Crossject et prendra fin le 17 février 2025.
Ce nouveau Directoire, désigné à l’unanimité par le Conseil de Surveillance, a été resserré et sera concentré sur les phases finales d’enregistrement du ZEPIZURE® auprès de la FDA, une étape transitoire clé dans la transformation de Crossject vers la commercialisation en directe aux Etats-Unis.
Patrick Alexandre, Président du Directoire et Philippe Monnot, Président du Conseil de Surveillance, ont déclaré : « Au nom de toute l’équipe et du Conseil de Surveillance, nous souhaitons remercier chaleureusement Olivier Giré pour ses contributions majeures dans la qualité des relations établies avec de nombreux partenaires internationaux et à travers toutes les étapes opérationnelles qui ont permis à Crossject de valider ZENEO®.»
Olivier Giré a ajouté : « Je remercie toute l’équipe de Crossject pour ces années intenses dédiées avec succès à l’émergence d’une technologie unique au monde, capable de révolutionner la valeur clinique des injectables dans de nombreuses indications. Je souhaite à l’équipe toute la réussite qu’elle mérite dans le lancement de ZEPIZURE® et de son portefeuille actuel de produits candidats ainsi que dans les prochaines initiatives exploitant la technologie ZENEO®. »
Au-delà de ses deux membres, qui ont fait partie de l’équipe fondatrice de Crossject, le nouveau Directoire de Crossject sera en mesure d’orchestrer l’exécution par une équipe de Management, comprenant des membres expérimentés dans les domaines stratégiques à Crossject sur les 18 prochains mois :
Tony Tipton, Chief Operating Officer USA ;
Olivier Lacombe, Directeur Développement Pharmaceutique ;
Marianne Svensson, Directeur Administratif et Financier ;
Didier Morin, Directeur Industriel.
|
Répondre
|
 0
0
Trop de dilution , titre à océanes et en plus la capi est trop haute je trouve vs comparables et concurrents chinois
|
Répondre
|
Un financement complexe au vu des montants impliqués
Le 10 février 2025
Le groupe a annoncé l’émission d’une deuxième tranche d’obligations à Heights Capital, liée à l’émission de février 2024, et a modifié les conditions des obligations. Dans l’ensemble, cela n’aura pas d’impact significatif sur nos chiffres, car la dilution supplémentaire est au moins partiellement voire totalement compensée par l’entrée de trésorerie.
ACTUALITÉ
Crossject a annoncé l’émission à Heights d’une deuxième tranche d’une valeur nominale de 2 496 400 €, à un prix d’émission de 90% de la valeur nominale, soit 2 246 400 €. Le groupe a également modifié les termes et conditions des OCA émises le 28 février 2024.
ANALYSE
Crossject a révisé les conditions de la première tranche comme suit : la date d’échéance des OCA a été repoussée du 28 février 2027 au 28 décembre 2027 ; l’amortissement bimensuel par OCA a été réduit de 6 000 € à 4 500 €, avec certaines exceptions ; le droit des détenteurs d’OCA de demander un remboursement anticipé a été modifié, permettant jusqu’à deux dates de remboursement sans que Crossject ait à payer le remboursement final en actions ; le prix de conversion des OCA est désormais le plus bas entre 1,677 € ou 110% de la valeur marchande à la date d’émission de la nouvelle tranche, avec un minimum de 1 € ; et la période d’ajustement du prix de conversion en cas d’émission de titres pour un montant brut minimum de €5m a été prolongée pour inclure le 28 février 2027. La nouvelle tranche d’OCA, d’un montant nominal de €2,246m, n’est pas conditionnée à l’approbation de la FDA/EUA.
Le prix de conversion pour toutes les OCA, si elles sont converties à la discrétion des détenteurs d’OCA, est fixé à 1,677 €, qui est le plus bas entre 1,677 € ou 110% de la valeur marchande à la date d’émission de la nouvelle tranche.
En résumé, le nombre potentiel de nouvelles actions résultant de la conversion de toutes les OCA varie de 5.251.905 à 8.80.045. En incluant la récente augmentation de capital en décembre 2024, qui a été intégrée dans nos chiffres, le nombre total d’actions pourrait passer d’environ 44m à un maximum de 55m. Sur la base de nos projections des tendances du prix de l’action, nous estimons 50,7 millions d’actions, ce qui n’affecte pas significativement notre prix cible. Cependant, nous trouvons ces opérations et modifications quelque peu complexes compte tenu des montants limités impliqués.
IMPACT
Nos prévisions restent largement inchangées à la lumière des nouvelles. Nous tiendrons compte d’un certain degré de dilution, qui sera partiellement ou totalement compensé par l’entrée de trésorerie.
|
Répondre
|
Crossject émet une deuxième tranche d'obligations convertibles pour augmenter son capital
Le 06 février 2025
Crossject (ALCJ.PA) a finalisé l'émission d'une deuxième tranche d'obligations convertibles d'un montant total de 2,5 millions d'euros à Heights Capital dans le cadre d'un accord de financement.
La société pharmaceutique française spécialisée a déclaré jeudi que la deuxième tranche comprend 32 obligations convertibles portant un taux d'intérêt de 7% par an et arrivant à échéance le 28 décembre 2027.
Le produit de la vente sera utilisé pour le développement du traitement de secours contre l'épilepsie Zepizure, les investissements en cours dans les centres de production, d'autres projets de recherche et de développement, ainsi que pour couvrir les frais généraux et administratifs.
|
Répondre
|
j" espère que la purge est bientôt terminée et un retour au-dessus de 2.13
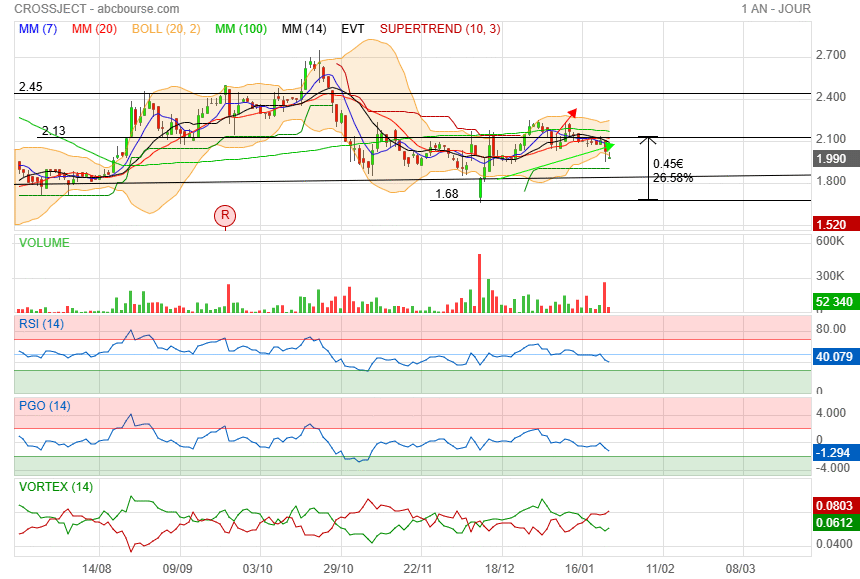
|
Répondre
|
ceux qui ont achetés à 1.68 vendent leurs titres à 2.13 !
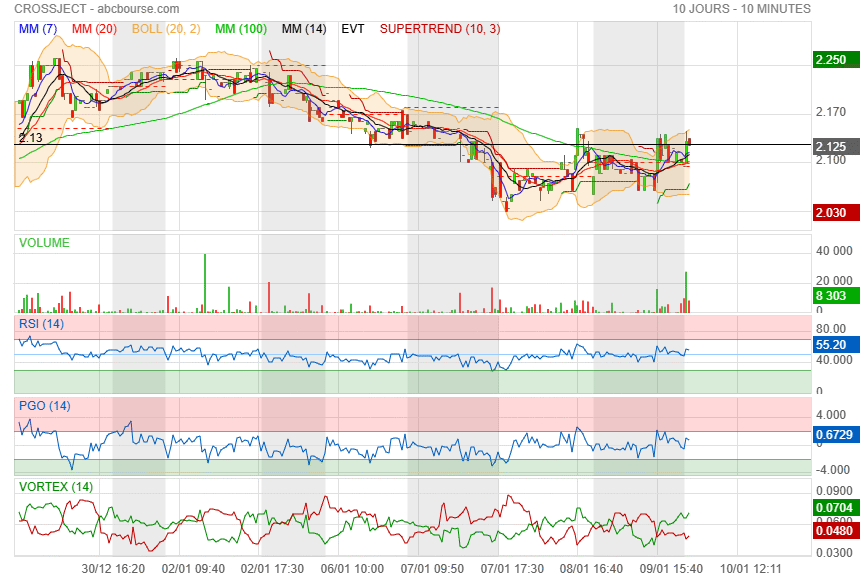
|
Répondre
|
a l instant ca vient de repasser au-dessus
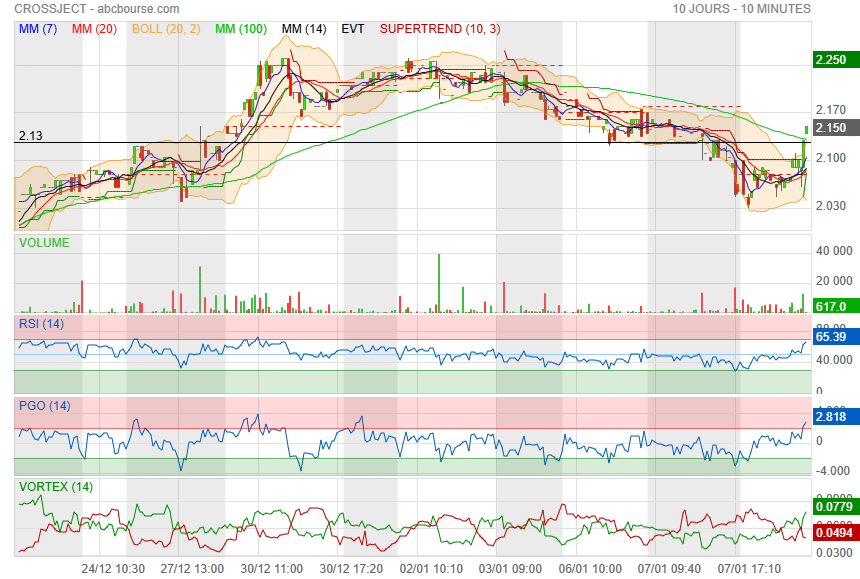
|
Répondre
|
P.A passe sur BFM le 10/01.
Il monte en grade.
|
Répondre
|
faudrait pas casser le support des 2.10/ 2.13
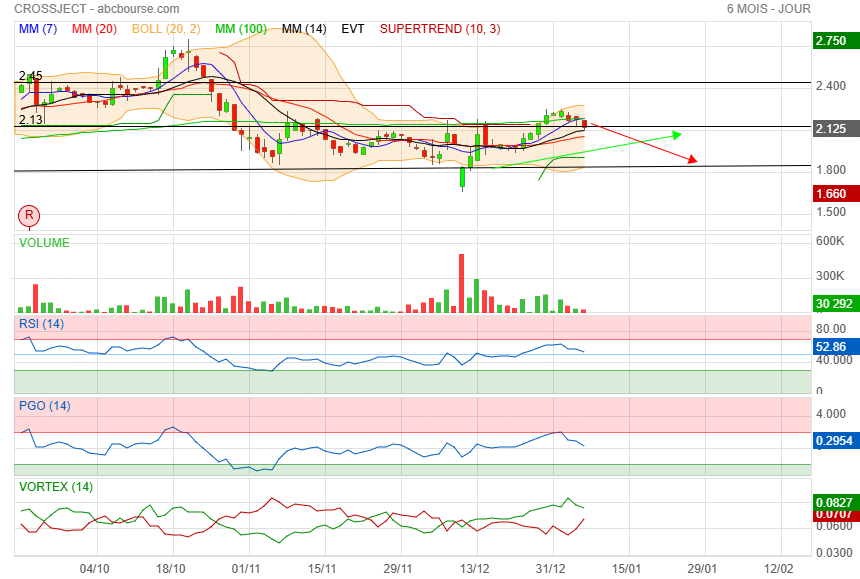
|
Répondre
|
On attend de pied ferme 👀 que les prévisions soient justes, à savoir :
Début 2025, nous avons deux échéances avec la FDA pour une livraison dès le début de l'année. Dans cette dernière ligne droite, Crossject poursuit le renforcement de ses équipes afin de sécuriser la production. Après cette première vente avec la Barda, la deuxième étape consistera à commercialiser le produit auprès du grand public sur prescription. Nous avons commencé à construire une équipe de commercialisation aux Etats-Unis, car ce pays est déjà le premier marché de transformation de Crossject en société pharmaceutique complète spécialiste de l'urgence, notamment des crises d'épilepsie, et nous suivons déjà le dossier des allergies.
|
Répondre
|
je l'espère bien !
j en ai encore repris aujourd hui
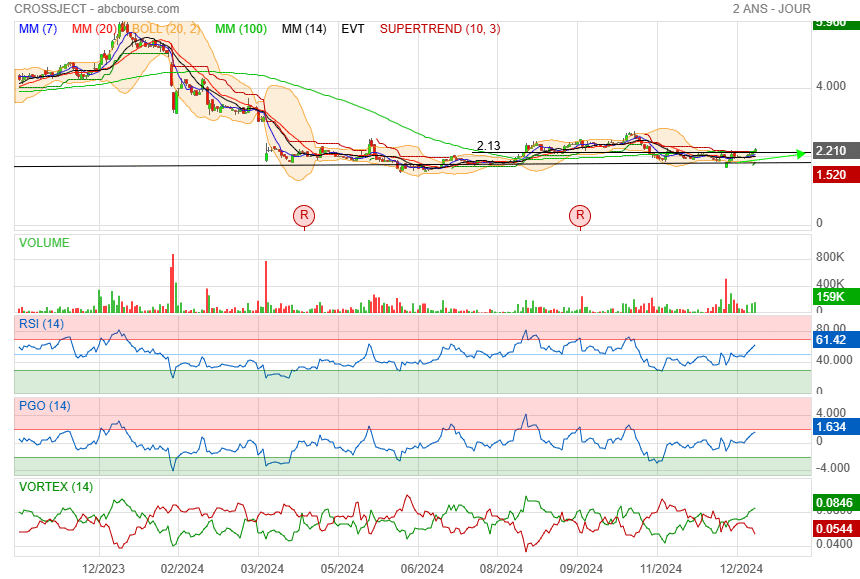
|
Répondre
|
C'est bientôt son heure . ;)
|
Répondre
|
 Suivez les marchés avec des outils de pros !
Suivez les marchés avec des outils de pros !