Valneva: contrôle direct des ventes d'Ixiaro aux Etats-Unis. - Page 5
Cours temps réel: 4,224 -2,81%| Cours | Graphes | News | Analyses et conseils | Société | Historiques | Vie du titre | Secteur | Forum |
Excellente publication semestrielle à 9 mois.
Valneva révise en hausse sa prévision de croissance des ventes de produits pour 2019 suite à de bons résultats sur les neuf premiers mois, et confirme la bonne exécution de ses programmes de R&D
21 Octobre 2019 [PDF] Saint Herblain
https://valneva.com/wp-content/uploads/2019/10/2019_31_10_VLA_9month_Results_PR_FR_Final-1.pdf
-------------------------------------------------------------------------------------------------------------
Révision à la hausse de la prévision de croissance des ventes de produits sur l’exercice 2019, prévision d’EBITDA confirmée
Valneva prévoit désormais des ventes de produits situées entre €125 millions et €130 millions, soit une croissance en glissement annuel supérieure à 20%. Valneva s’attendait précédemment à une croissance des ventes de produits située entre €115 millions et €125 millions.
o Prévision confirmée d’un chiffre d’affaires total pour l’exercice 2019 situé entre €125 millions et €130 millions, y compris l’impact de la fin de l’alliance stratégique (SAA) avec GlaxoSmithKline (GSK) 1 o HorsimpactdelafinduSAA,lechiffred’affairestotalprévusesitueraitentre€135 millions et €140 millions sur l’exercice 2019
Le Groupe confirme sa prévision d’un EBITDA situé entre €5 millions et €10 millions en 2019.
o Hors impact de la fin du SAA, l’EBITDA prévu se situerait entre €15millions et €20 millions sur l’exercice 2019
Deux avancées R&D majeures annoncées au troisième trimestre
Finalisation du recrutement des patients pour les deux études de Phase 2 du candidat vaccin contre la maladie de Lyme VLA15
Financement d’une valeur maximale de $23,4 millions octroyé par CEPI (“Coalition for Epidemic Preparedness Innovations”) pour le développement avancé du candidat vaccin contre le chikungunya VLA15532. Bons résultats financiers sur les neuf premiers mois de l’exercice 2019
Ventes de produits de €86,4 millions sur les neuf premiers mois de 2019, soit une croissance de 22% en glissement annuel (18% à taux de change constants)
o Croissance significative du chiffre d’affaires d’IXIARO® de 28% (24% à taux de change constants) à €64,2 millions sur les neuf premiers mois de l’exercice 2019 soutenue principalement par une croissance des ventes aux Etats-Unis
o Croissance du chiffre d’affaires de DUKORAL® de 6% (5% à taux de change constants) à €19,8 millions sur les neuf premiers mois de l’exercice 2019
Chiffre d’affaires total de €81,4 millions sur les neuf premiers mois de l’exercice 2019
o €92,1millions hors impact de la fin du SAA avec GSK
Marge brute (sur le chiffre d’affaires des ventes de produits) de 65,2% sur les neuf premiers mois de l’exercice 2019 (comparée à 59,7% sur la même période en 2018) – croissance principalement soutenue par la répartition des ventes et une amélioration des capacités de production
EBITDA de €3,0 millions sur les neuf premiers mois de l’exercice 2019 o EBITDA de €13,7 million hors impact de la fin du SAA avec GSK
Perte nette de €2,4 millions sur les neuf premiers mois de l’exercice 2019
o Bénéficenetde€8,3millions hors impact de la fin du SAA avec GSK
Solide position de trésorerie à €67,4 millions à fin septembre 2019
o y compris un paiement de €9 millions effectué dans le cadre de la fin de l’alliance stratégique avec GSK SAA et le tirage d’une nouvelle tranche de €10 millions dans le cadre du prêt accordé par la Banque Européenne d’Investissement (EIB)
SUITE du communiqué au lien indiqué avec détails concernant les différents dossiers en cours.
.
|
Répondre
|
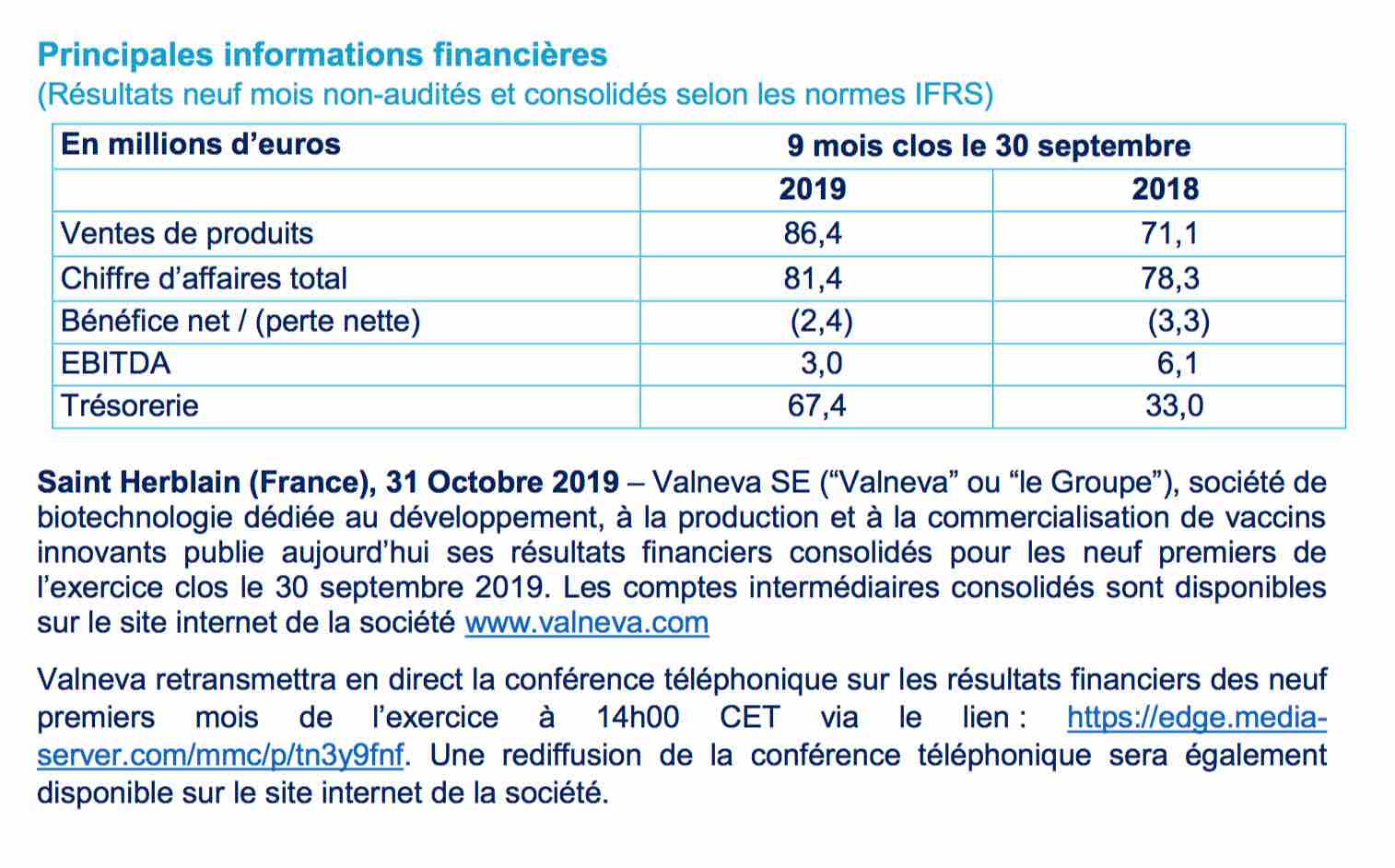
Consolidation sur les niveaux actuels avant reprise haussière prochaine (...qui pourrait être importante...)
Depuis mon précédent graphe, on constatera que le comblement du Gap Haussier sur 2,98 que je pointais à la baisse aura mis 8 mois pour se réaliser.
Voici donc le graphe est donc enfin purgé de ce risque.
Comme on le voit çi-dessous dans les 2 posts précédents, Valneva continue financièrement de progresser en améliorant ses ventes et sa rentabilité : le point mort est désormais nettement dépassé.
Certe, la trésorerie va être grevée par des étapes importantes des candidats vaccins Lyme et Chikungunya : mais on disposait de plus de 81 Millions D'euros, et passe actuellement sous 69 Md'e. Mais ça reste très confortable les années à venir.
Coté graphique, on vient de raliser un petit "W" haussier sur le comblement du gap à 2,98 et on consolide latéralement en position basse. La MM 20 se retourne, on visera un retour progressif sur la MM 200 vers 3,30 et qui validerait le retour sur la médiane d'Andrew en Marron.
On notera que la dent intermédiaire de fourchette marron et jaune a servit avec efficacité de support à la baisse.
Les indicateurs à l'image du RSI montent un net retour de l'engouement pour le titre après publication semestrielle.
On surveillera à la hausse le retour sur la keltner Haute actuellement à 3,20 qiui sera un signal de reprise haussière.
Si les éléments de publication restent favorables, on pourra envisager une sortie par le haut de la fourchette baissière vers 3,50 euros...
.
|
Répondre
|
On retiendra, selon moi, de cette excellente publication une très bonne gestion des moyens financiers qui démontre que Valaneva devient financièrement opérationnel en ayant dépassé le point mort comptable.
Je cite : " Un bénéfice net de €8.3 millions hors impact de la fin du SAA contre une perte nette de €0,2 millions au premier semestre de l’exercice précédent "
Valvena devient donc nettement bénéficiaire. L'élément exceptionel qui impact le CA semestriel afin refléter les obligations de paiements actuels et futurs liées à la fin de cette alliance témoigne d'une gestion plutôt saine : ces sommes n'impacteront pas les comptes à venir et réduisent les charges d'imposition (Basculement du RN en négatif) pour conserver plus de moyens notamment en matière de trésorerie afin de poursuivre le développement des candidat vaccins prometteurs...
|
Répondre
|
 0
0
@ alèze
je te remonte le topic pour que tu vérif que ces forums de tchat existent
|
Répondre
|
Valneva : annonce le tirage d'une nouvelle tranche de 10 millions d'€ dans le cadre du prêt accordé par la Banque Européenne d'Investissement
16/07/2019 | 17:47 Communiqué de presse
https://ml-eu.globenewswire.com/Resource/Download/642eb91b-9c94-4135-b864-925bbec5f078
-----------------------------------------------------------------------------------------------------------------------------------
Valneva annonce le tirage d’une nouvelle tranche de 10 millions d'€ dans le cadre du prêt accordé par la Banque Européenne d’Investissement
Saint Herblain (France), 16 juillet 2019 – Valneva SE (“Valneva” ou “le Groupe”), société de biotechnologie développant et commercialisant des vaccins contre des maladies infectieuses générant d’importants besoins médicaux, a annoncé aujourd’hui avoir effectué le tirage d’une nouvelle tranche de €10 millions dans le cadre du prêt accordé par la Banque Européenne d’Investissement (BEI). Le prêt de €25 millions avait été accordé au Groupe par la BEI en juillet 2016.
Avec cette nouvelle tranche, Valneva aura tiré €20 millions1 sur les €25 millions mis à la disposition du Groupe dans le cadre du prêt de la BEI. Valneva ne prévoit pas de tirer les €5 millions restants.
Valneva prévoit d’allouer les fonds reçus à l’avancée de ses programmes de R&D, dont ses candidats vaccins contre la maladie de Lyme et le chikungunya.
David Lawrence, Directeur financier de Valneva, a indiqué, “Nous continuons à nous assurer, par le tirage de cette nouvelle tranche de €10 millions, que nous disposons d’un financement confortable pour le développement clinique de nos actifs prometteurs. Nous souhaitons, par ailleurs, remercier une nouvelle fois la BEI pour son soutien.”
Selon les termes de l’accord signé avec la BEI, chaque tranche est remboursable à la fin d’une période de cinq ans après tirage.
A propos de Valneva SE
Valneva est une société de biotechnologie développant et commercialisant des vaccins contre des maladies infectieuses engendrant d’importants besoins médicaux. Le portefeuille de produits de Valneva inclut deux vaccins du voyageur, IXIARO®/JESPECT® contre l’encéphalite japonaise et DUKORAL® dans la prévention du choléra et, dans certains pays, de la diarrhée causée par l’ETEC. Le groupe est également propriétaire d’un solide portefeuille de vaccins en développement dont le seul candidat vaccin en phase clinique contre la maladie de Lyme. Valneva compte environ 480 employés et exerce ses activités depuis l’Autriche, la Suède, la Grande-Bretagne, la France, le Canada et les Etats-Unis. Pour plus d’information, consulter le site internet de la société www.valneva.com.
Valneva Investor and Media Contacts
Laetitia Bachelot-Fontaine
Global Head of Investor Relations &
Corporate Communications
M +33 (0)6 4516 7099
investors@valneva.com
|
Répondre
|
Comme prévu... Des frais en moins pour 2019...
Valneva : retrait de cotation à la bourse de Vienne
Communiqué de presse | 02/07/19
-----------------------------------------------------------------------------------------
Valneva annonce avoir déposé une demande de radiation de ses actions ordinaires auprès de la Bourse de Vienne.
Le retrait des actions Valneva de la cote de la bourse de Vienne a été approuvé lors de l'Assemblée Générale annuelle du Groupe qui s'est tenue à Paris le 27 juin 2019.
La radiation des actions à la Bourse de Vienne devrait prendre effet fin 2019. La cotation sur Euronext Paris demeure inchangée
' Le Groupe a pris cette décision afin de se concentrer sur les marchés de capitaux les plus attractifs pour les sociétés des sciences de la vie et d'accroître la liquidité de ses titres en centralisant les transactions sur Euronext Paris ' indique la direction.
|
Répondre
|
VALNEVA : résultats positifs pour la première évaluation de la dose de rappel du vaccin contre la maladie de Lyme et les données finales de l'étude de Phase 1
Communiqué de presse (PDF) | 31/01/2019 | 07:02
http://hugin.info/143334/R/2232927/878226.pdf
_________________________________________________________________________________
Saint-Herblain (France), 31 janvier 2019 - Valneva SE ("Valneva" ou "le Groupe"), société de biotechnologie développant et commercialisant des vaccins contre des maladies infectieuses générant d'importants besoins médicaux, a publié aujourd'hui des résultats positifs pour la première évaluation de la dose de rappel de son candidat vaccin contre la maladie de Lyme VLA15 ainsi que les données finales de l'étude de Phase 1.
Afin de déterminer si une dose de rappel du vaccin VLA15 pourrait provoquer une réponse anamnestique[1], Valneva a modifié son protocole d'étude de Phase 1 au cours de l'année 2018 pour ajouter un rappel dans une sous-cohorte de la population de Phase 1. En parallèle, l'intégralité des participants à l'étude de Phase 1 a fait l'objet d'un suivi pendant un an pour toutes les doses du vaccin testées, permettant ainsi d'obtenir des résultats finaux de Phase 1.
Ces résultats finaux de Phase 1 ont confirmé, à différents moments dans le temps, le profil d'innocuité et de tolérance qui avait été observé lors de l'analyse des résultats intermédiaires. VLA15 a démontré un profil d'innocuité favorable et aucun problème de sécurité n'a été constaté dans les groupes vaccinés. Par ailleurs, l'analyse des résultats finaux d'immunogénicité a indiqué que le vaccin provoquait une réponse immunitaire plus forte dans les groupes vaccinés avec une formulation adjuvantée du vaccin, confirmant ainsi les résultats obtenus lors de l'analyse intermédiaire de Phase 1. Comme il était attendu sur la base des données intermédiaires de Phase 1, les titres d'anticorps diminuent dans tous les groupes vaccinés au-delà du 84ème jour suivant la première vaccination et tendent à se rapprocher de leur valeur initiale environ un an après la première vaccination.
Afin d'évaluer le bénéfice potentiel de l'administration d'une dose de rappel, 64 sujets dans les deux groupes vaccinés en Phase 1 avec la plus forte dose du vaccin (48µg et 90µg, avec et sans alum) ont reçu une dose de rappel entre 12 et 15 mois suivant leur première vaccination. Cette revaccination a provoqué une réponse immunitaire extrêmement forte, produisant des titres d'anticorps OspA 2,7x (ST3[2]) - 5,8x (ST1) supérieurs à l'augmentation moyenne géométrique (GMFR) constatée des titres d'anticorps lors des résultats intermédiaires au Jour 84 de l'étude. Ces résultats sont comparables aux données publiées pour d'autres vaccins précédemment en développement contre la maladie de Lyme et basés sur le polypeptide OspA.
Wolfgang Bender, M.D., Ph.D., Directeur Médical de Valneva, a indiqué, "Ces résultats encourageants viennent conforter nos plans et projets actuels de développement pour notre programme le plus avancé, VLA15. Compte tenu de ces résultats, nous avons décidé d'inclure une dose de rappel de VLA15 dans l'étude de Phase 2 actuellement en cours.Répondre aux besoins médicaux croissants et non satisfaits causés par la maladie de Lyme demeure notre priorité absolue.VLA15 reste aujourd'hui le seul vaccin en développement clinique contre la maladie de Lyme dans le monde."
Valneva avait publié des données intermédiaires sur le critère d'évaluation principal de l'étude de Phase 1 (VLA15-101) en mars 2018[3].
Compte tenu de l'écart entre la réponse immunitaire la plus faible et la plus forte ainsi que de la variabilité entre les différents sérotypes (les taux de séroconversion à Jour 84 se situaient entre 71.4% (ST1) et 96.4%(ST2)), l'étude de Phase 2 actuellement en cours (VLA15-201) inclut deux dosages plus élevés du vaccin (135 µg et 180µg, adjuvantés à l'alum), et une étude évaluant un schéma de vaccination alternatif (VLA15-202) devrait être initiée mi-2019.
La Phase 2 devrait durer approximativement deux ans avec une publication des premiers résultats (sur le critère principal de l'étude) attendue mi-2020.
A propos de l'étude clinique de Phase 2 VLA15-201
VLA15-201 est la première de deux études de phase 2 devant être menées en parallèle. L'essai clinique, randomisé à l'insu des observateurs et contrôlé par placebo, sera conduit sur différents sites aux Etats-Unis et en Europe.
120 sujets recevront, dans un premier temps, soit l'un des trois dosages du vaccin soit un placebo. Cette première vaccination sera suivie par une revue des données d'innocuité effectuée par un Comité de surveillance et de suivi des données (DSMB). 450 sujets recevront ensuite, lors de l'étude principale, l'un des deux dosages du vaccin (180 sujets par dosage) ou le placebo (90 sujets).
VLA15 sera testé dans une formulation adjuvantée à l'alum par administration intramusculaire effectuée à Jours 1, 29 et 57. Les sujets seront suivis pendant un an avec une lecture des données d'immunogénicité à Jour 85 (critère principale de l'étude). L'étude porte sur des adultes en bonne santé âgés de 18 à 65 ans. Les centres d'essais cliniques seront situés dans des régions où la maladie de Lyme est endémique. Des sujets ayant été précédemment infectés par la bactérie Borrelia burgdorferi, à l'origine de la maladie de Lyme seront également inclus dans l'étude.
A propos de la maladie de Lyme
La maladie de Lyme est une infection systémique causée par la bactérie Borrelia transmise à l'homme par les tiques Ixodes[4]. Elle est aujourd'hui considérée comme la maladie transmise par vecteur la plus commune de l'hémisphère nord. Selon l'organisme américain de contrôle et de prévention des maladies (CDC), environ 300 000 américains[5] sont diagnostiqués chaque année et au moins 200 000 cas seraient également recensés chaque année en Europe[6]. Les premiers symptômes de la maladie (éruption érythémateuse ou d'autres symptômes moins spécifiques de la maladie tels que fatigue, fièvre, maux de tête, rigidité de la nuque, arthralgie ou myalgie) sont souvent ignorés ou mal interprétés. En cas de traitement tardif ou inadéquat de la maladie, l'infection peut conduire à de sévères complications articulaires (arthrite), cardiaques (cardite) ou du système nerveux central. Le besoin médical pour un vaccin contre la maladie de Lyme ne cesse d'augmenter alors que la maladie continue à s'étendre géographiquement[7].
A propos de VLA15
Le candidat vaccin de Valneva, VLA15, est actuellement le seul programme clinique actif contre la maladie de Lyme. Ce programme a reçu le statut de "Fast track" de l'autorité de santé américaine, FDA, en juillet 2017[8] et Valneva a publié des résultats initiaux positifs de Phase 1 en mars 2018[9]. VLA15 a montré un profil d'innocuité favorable et était immunogène dans tous les dosages et formulations testés avec une bonne réponse des anticorps IgG spécifiques de l'OspA contre tous les sérotypes d'OspA.
VLA15 est un vaccin multivalent à sous-unités de protéines ciblant la surface externe de la protéine A (OspA) de la Borrelia. L'indication ciblée par le candidat vaccin de Valneva est une immunisation prophylactique active contre la maladie de Lyme avec pour objectif d'offrir une protection contre la majorité des souches de Borrelia pathogènes pour l'homme.
VLA15 est conçu pour offrir une protection contre la maladie de Lyme en augmentant le niveau des anticorps qui empêchent la bactérie Borrelia de migrer de la tique à l'homme après une morsure. Le profil d'innocuité du vaccin devrait être semblable à celui d'autres vaccins qui utilisent la même technologie et qui ont déjà été approuvés pour une immunisation active chez l'adulte et l'enfant.
La population ciblée par le vaccin inclut les individus à risque, âgés de plus de deux ans, vivant dans les zones endémiques, les personnes ayant prévu de voyager dans les zones endémiques et de pratiquer des activités de plein air ainsi que les personnes ayant déjà été touchées par la maladie (puisqu'une infection par Borrelia ne confère pas d'immunité protectrice contre toutes les souches de Borrélia pathogènes pour l'homme).
La vaccination par OspA a déjà prouvé son efficacité dans les années 90 et les données précliniques du vaccin VLA15 ont révélé que ce candidat vaccin avait le potentiel pour offrir une protection contre la majorité des souches de Borrelia pathogènes pour l'homme[10].
A propos de Valneva SE
Valneva est une société de biotechnologie développant et commercialisant des vaccins contre des maladies infectieuses engendrant d'importants besoins médicaux. Le portefeuille de produits de Valneva inclut deux vaccins du voyageur, IXIARO®/JESPECT® contre l'encéphalite japonaise et DUKORAL® dans la prévention du choléra et, dans certains pays, de la diarrhée causée par l'ETEC. Le groupe est également propriétaire d'un solide portefeuille de vaccins en développement dont le seul candidat vaccin en phase clinique contre la maladie de Lyme. Valneva compte environ 470 salariés et exerce ses activités depuis l'Autriche, la Suède, la Grande-Bretagne, la France, le Canada et les Etats-Unis. Pour plus d'information, consulter le site internet de la société www.valneva.com.
Valneva Investor and Media Contacts
Laetitia Bachelot-Fontaine
Global Head of Investor Relations &
Corporate Communications
M +33 (0)6 4516 7099
investors@valneva.com
Teresa Pinzolits
Corporate Communications Specialist
T +43 (0)1 20620 1116
communications@valneva.com
|
Répondre
|
Calendrier Financier 2019 de Valneva
• 21 février 2019 : Chiffre d'affaires 2018
• 21 mars 2019 : 2018 Résultats annuels
• 2 mai 2019 : Résultats T1 2019
• 24 juin 2019 : AGM Record Date
• 27 juin 2019 : Assemblée générale des Actionnaires 2019
• 1 aout 2019 : Résultats semestriels 2019
• 31 octobre 2019 : Résultats 9M 2019
|
Répondre
|
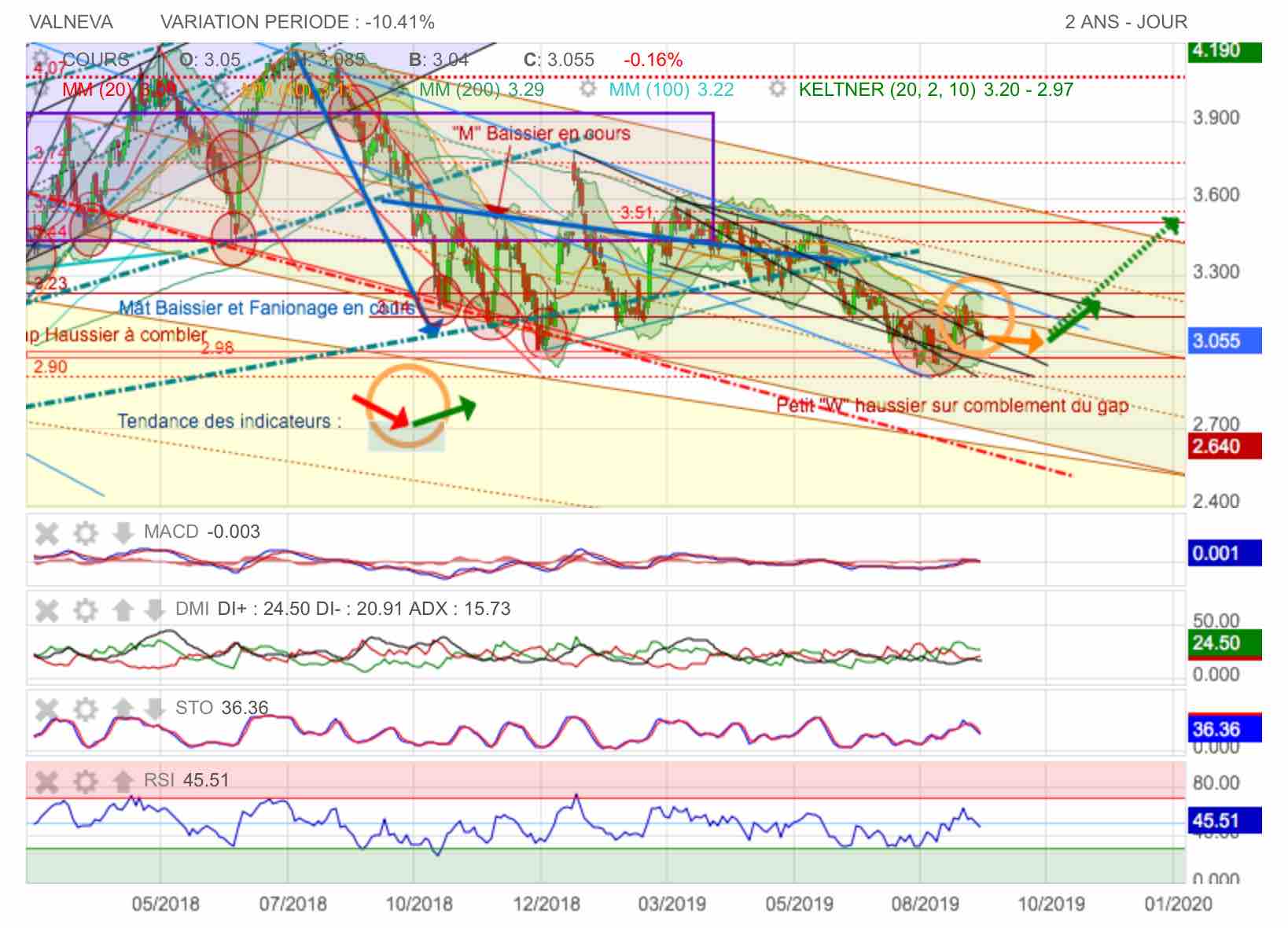
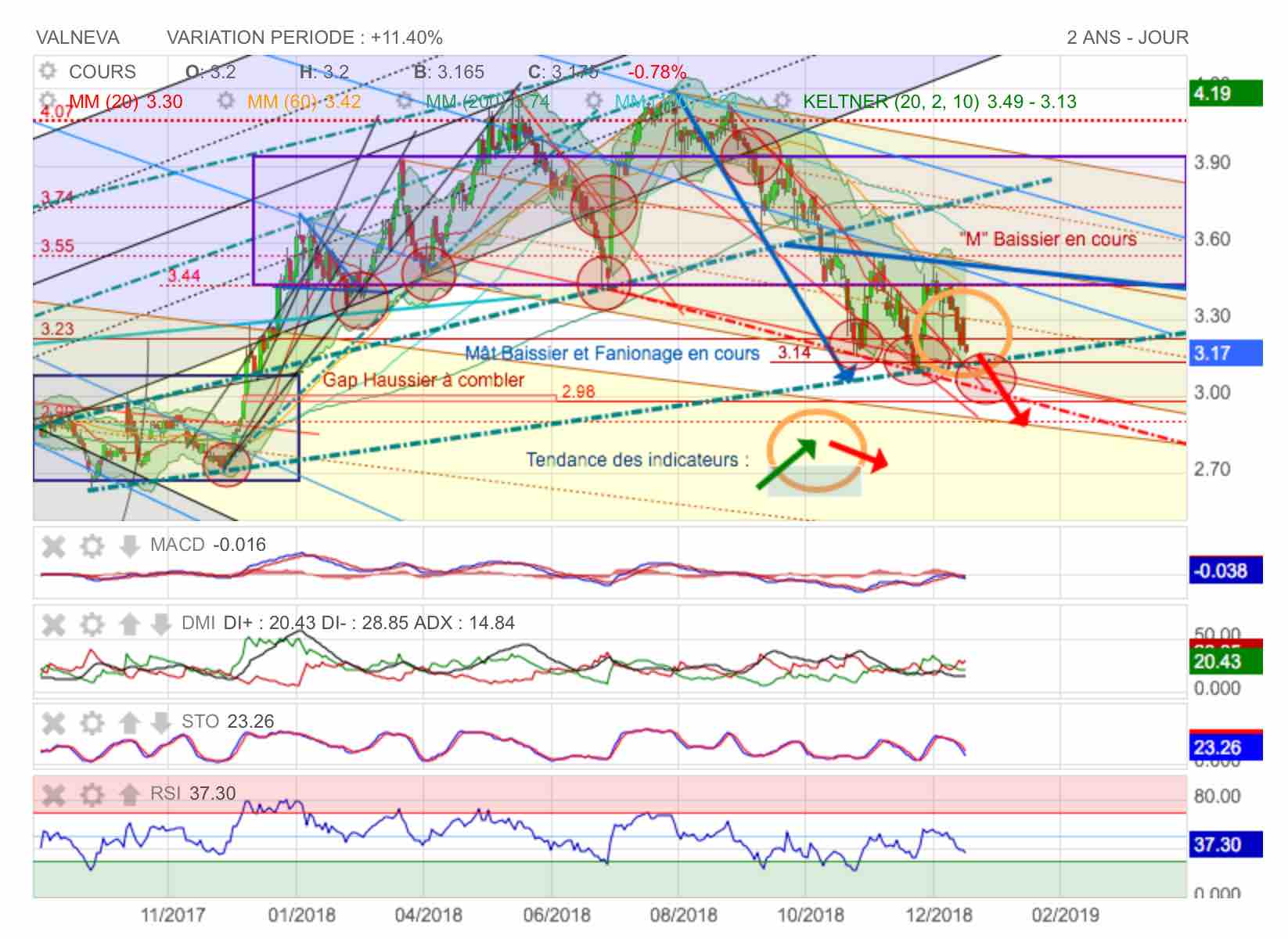
Conjecture baissière sous le poids d'éléments graphiques négatifs.
Plusieurs choses se sont liguées à la baisse dans les publications de Valneva. Certes les travaux progressent bien sur candidats et le CA continue de croître. En revanche, ce qui a été diversement apprécié, c'est l'augmentation de capital réservé en Septembre qui a été relativement dilutive et la publication à 9 mois, montre une consommation de trésorerie accrue et une baisse de rentabilité importante en terme d'EBIDTA notamment sur le 3ème trimestre 2018.
Coté graphique, la phase haussière a connue une baisse importante et on menace actuellement d'enfoncer le second support de mouvement haussier (pointillés verts) vers 3,14 euros.
On notera sue 4,07 le triple top de sommet qui a lancé un mât baissier en bleu sur lequel on effectue actuellement un fanion.
La construction de ce fanion baissier a entrainé un triple top à la baisse sur l'oblique de support rouge au niveau des pointillés rouges (cercles rouges) : on achève actuellement dans le fanion bleu un grand "M" et donc logiquement on devrait aller tester la batterie de supports au dessous avec un pint de mire le comblement du gap haussier sur 2,98 euros.
On notera encore que si le MACD est bien remonté suite à une balle relance du RSI, la courbe des cours a montré un potentiel de hausse limité sous l'influence des DM qui demeurent au coude à coude sans rivver à prendre le pas l'une sur l'autre. C'est la DM rouge négative qui devrait gagner le combat à la baisse donc...
Comblement du Gap sur 2,98 en vue...
.
.
|
Répondre
|
Valneva : lance la Phase 2 du développement de son vaccin contre la maladie de Lyme
17/12/2018 | 07:01 | Communiqué de Presse
Saint-Herblain (France), 17 décembre 2018 - Valneva SE ("Valneva"), société de biotechnologie développant et commercialisant des vaccins contre des maladies infectieuses générant d'importants besoins médicaux, a annoncé aujourd'hui l'initiation de la Phase 2 du développement clinique de son candidat vaccin contre la maladie de Lyme, VLA15.
L'objectif principal de l'étude de Phase 2 est de déterminer, en se basant sur les données d'immunogénicité et d'innocuité, le meilleur dosage du vaccin ainsi que le meilleur schéma d'administration pour les études pivot d'efficacité qui seront menées en Phase 3.
La Phase 2 de développement du candidat vaccin contre la maladie de Lyme inclura une évaluation du dosage le plus élevé de VLA15 testé en Phase 1 ainsi que deux dosages plus élevés du vaccin. Le Groupe prévoit, par ailleurs, d'inclure l'évaluation d'un schéma de vaccination alternatif au cours duquel trois doses du vaccin seront administrées.
Wolfgang Bender, MD, PhD, Chief Medical Officer de Valneva a indiqué, "Les cas de maladie de Lyme aux Etats-Unis ont augmenté de façon dramatique ces trente dernières années, générant également une augmentation substantielle des coûts de la maladie pour les systèmes de santé. La peur de contracter la maladie de Lyme diminue la qualité de vie des personnes, quel que soit leur âge. Le besoin médical pour un vaccin contre la maladie de Lyme ne cesse d'augmenter alors que la maladie continue à s'étendre géographiquement. Valneva fait tout son possible, en consultation avec la FDA et l'EMA[1], pour développer un vaccin sûr et efficace, dans le cadre de son statut de « Fast Track ».
La Phase 2 devrait durer approximativement deux ans avec une publication des premiers résultats (sur le critère principal de l'étude) attendue mi 2020.
A propos de l'étude clinique de Phase 2 VLA15-201
VLA15-201 est la première de deux études de phase 2 devant être menées en parallèle. L'essai clinique, randomisé à double aveugle et contrôlé par placebo, sera conduit sur différents sites aux Etats-Unis et en Europe.
120 sujets recevront, dans un premier temps, soit l'un des trois dosages du vaccin soit un placebo. Cette première vaccination sera suivie par une revue des données d'innocuité effectuée par un Comité de surveillance et de suivi des données (DSMB). 450 sujets recevront ensuite, lors de l'étude principale, l'un des deux dosages du vaccin (180 sujets par dosage) ou le placebo (90 sujets).
VLA15 sera testé dans une formulation adjuvantée à l'alum par administration intramusculaire effectuée à Jours 1, 29 et 57. Les sujets seront suivis pendant un an avec une lecture des données d'immunogénicité à Jour 85 (critère principale de l'étude). L'étude porte sur des adultes en bonne santé âgés de 18 à 65 ans. Les centres d'essais cliniques seront situés dans des régions où la maladie de Lyme est endémique; des sujets ayant été précédemment infectés par la bactérie Borrelia burgdorferi, à l'origine de la maladie de Lyme seront également inclus dans l'étude.
A propos de la maladie de Lyme
La maladie de Lyme est une infection systémique causée par la bactérie Borrelia transmise à l'homme par les tiques Ixodes[2]. Elle est aujourd'hui considérée comme la maladie transmise par vecteur la plus commune de l'hémisphère nord. Selon l'organisme américain de contrôle et de prévention des maladies (CDC), environ 300 000 américains[3] sont diagnostiqués chaque année et au moins 200 000 cas seraient également recensés chaque année en Europe[4]. Les premiers symptômes de la maladie (éruption érythémateuse ou d'autres symptômes moins spécifiques de la maladie tels que fatigue, fièvre, maux de tête, rigidité de la nuque, arthralgie ou myalgie) sont souvent ignorés ou mal interprétés. En cas de traitement tardif ou inadéquat de la maladie, l'infection peut conduire à de sévères complications articulaires (arthrite), cardiaques (cardite) ou du système nerveux central. Le besoin médical pour un vaccin contre la maladie de Lyme ne cesse d'augmenter alors que la maladie continue à s'étendre géographiquement[5].
A propos de VLA15
Le candidat vaccin de Valneva, VLA15, est actuellement le seul programme clinique actif contre la maladie de Lyme. Ce programme a reçu le statut de "Fast track" de l'autorité de santé américaine, FDA, en juillet 2017[6] et Valneva a publié des résultats initiaux positifs de Phase 1 en mars 2018[7]. VLA15 a montré un profil d'innocuité favorable et était immunogène dans tous les dosages et formulations testés avec une bonne réponse des anticorps IgG spécifiques de l'OspA contre tous les sérotypes d'OspA.
VLA15 est un vaccin multivalent à sous-unités de protéines ciblant la surface externe de la protéine A (OspA) de la Borrelia. L'indication ciblée par le candidat vaccin de Valneva est une immunisation prophylactique active contre la maladie de Lyme avec pour objectif d'offrir une protection contre la majorité des souches de Borrelia pathogènes pour l'homme.
VLA15 est conçu pour offrir une protection contre la maladie de Lyme en augmentant le niveau des anticorps qui empêchent la bactérie Borrelia de migrer de la tique à l'homme après une morsure. Le profil d'innocuité du vaccin devrait être semblable à celui d'autres vaccins qui utilisent la même technologie et qui ont déjà été approuvés pour une immunisation active chez l'adulte et l'enfant.
La population ciblée par le vaccin inclut les individus à risque, âgés de plus de deux ans, vivant dans les zones endémiques, les personnes ayant prévu de voyager dans les zones endémiques et de pratiquer des activités de plein air ainsi que les personnes ayant déjà été touchées par la maladie (puisqu'une infection par Borrelia ne confère pas d'immunité protectrice contre toutes les souches de Borrélia pathogènes pour l'homme).
La vaccination par OspA a déjà prouvé son efficacité dans les années 90 et les données précliniques du vaccin VLA15 ont révélé que ce candidat vaccin avait le potentiel pour offrir une protection contre la majorité des souches de Borrelia pathogènes pour l'homme[8].
A propos de Valneva SE
Valneva est une société de biotechnologie développant et commercialisant des vaccins contre des maladies infectieuses engendrant d'importants besoins médicaux. Le portefeuille de produits de Valneva inclut deux vaccins du voyageur, IXIARO®/JESPECT® contre l'encéphalite japonaise et DUKORAL® dans la prévention du choléra et, dans certains pays, de la diarrhée causée par l'ETEC. Le groupe est également propriétaire d'un solide portefeuille de vaccins en développement dont le seul candidat vaccin clinique contre la maladie de Lyme. Valneva compte plus de 450 employés et exerce ses activités depuis l'Autriche, la Suède, la Grande-Bretagne, la France, le Canada et les Etats-Unis. Pour plus d'information, consulter le site internet de la société www.valneva.com.
Valneva Investor and Media Contacts
Laetitia Bachelot-Fontaine
Global Head of Investor Relations &
Corporate Communications
M +33 (0)6 4516 7099
investors@valneva.com
Teresa Pinzolits
Corporate Communications Specialist
T +43 (0)1 20620 1116
communications@valneva.com
|
Répondre
|
Valneva : et HOOKIPA signent un accord de collaboration et de fabrication
06/12/2018 | 17:46 | Communiqué de presse
Saint-Herblain, France et Vienne, Autriche, 6 décembre 2018 - Valneva Sweden AB, la filiale suédoise de Valneva SE ("Valneva"), et Hookipa Pharma Inc. ("Hookipa") ont annoncé aujourd'hui la signature d'un accord de collaboration et de fabrication d'une durée de trois ans.
Selon les termes de l'accord, Valneva Sweden fournira des services d'analyse, développera une mise à l'échelle des procédés de fabrication et produira du matériel d'essai clinique conforme aux Bonnes Pratiques de Fabrication (BPF) pour le développement de nouvelles immunothérapies basées sur les technologies d'immunisation par vecteur des arénovirus TheraT® et Vaxwave® de Hookipa. En contrepartie, Valneva recevra des sommes fixes ainsi que des paiements liés à l'avancement des projets. L'accord pourrait être prolongé au-delà de cette période de trois ans.
Janet Hoogstraate, Présidente de Valneva Sweden, a indiqué, "Nous nous réjouissons de travailler avec Hookipa sur le développement de nouvelles immunotherapies visant à combattre les maladies infectieuses et le cancer. Cette collaboration est une reconnaissance forte des très grandes compétences techniques et industrielles de Valneva. Notre unité dédiée en Suède a développé une excellente réputation en terme de développement et production de matériel d'essais cliniques.
Joern Aldag, Chief Executive Officer de Hookipa a ajouté, "Cette collaboration avec Valneva va nous donner accès à des installations répondant aux normes BPF ainsi qu'à une main d'oeuvre compétente pouvant produire du matériel clinique selon nos besoins spécifiques. Cette collaboration vient également renforcer notre stratégie consistant à nous assurer suffisamment de capacité de production, réduire les délais d'exécution, et accroître la robustesse et la cohérence des procédés. Nous nous réjouissons de travailler avec les formidables équipes de Valneva."
A propos de Valneva SE
Valneva est une société de biotechnologie spécialisée dans le développement et la commercialisation de vaccins contre les maladies infectieuses engendrant d'importants besoins médicaux. Le portefeuille de produits de Valneva inclut deux vaccins du voyageur, IXIARO®/JESPECT® contre l'encéphalite japonaise et DUKORAL® dans la prévention du choléra et, dans certains pays, de la diarrhée causée par L'ETEC. Le groupe est également propriétaire d'un solide portefeuille de vaccins en développement dont le seul candidat vaccin contre la maladie de Lyme. Valneva compte plus de 450 employés et exerce ses activités depuis l'Autriche, la Suède, la Grande-Bretagne, la France, le Canada et les Etats-Unis. Pour plus d'information, consulter le site internet de la société www.valneva.com.
A propos d'Hookipa
HOOKIPA Pharma Inc. est une société biopharmaceutique au stade clinique qui développe des immunothérapies de nouvelle génération contre les maladies infectieuses et le cancer grâce à sa plateforme d'arénovirus conçue pour reprogrammer le système immunitaire du corps.
Nos technologies exclusives à base d'arénavirus, Vaxwave®*, un vecteur viral déficient en réplication, et TheraT®*, un vecteur viral à réplication atténuée, sont conçues pour induire des cellules T CD8+ antigènes spécifiques robustes et des anticorps neutralisant les pathogènes. Vaxwave® et TheraT® sont toutes deux conçues pour permettre une administration répétée tout en maintenant une réponse immunitaire. TheraT®* a le potentiel d'induire des taux de réponse des lymphocytes T CD8+ n'ayant jamais été atteints auparavant dans d'autres approches immunothérapeutiques publiées. Nos vecteurs viraux " standard " ciblent les cellules dendritiques in vivo pour activer le système immunitaire.
Nous venons de terminer avec succès une étude de phase 1 sur un vaccin prophylactique basé sur la technologie Vaxwave® pour la protection contre l'infection au cytomégalovirus. Nous avons commencé le recrutement pour une étude de phase 2 chez des patients séronégatifs au cytomégalovirus qui sont en attente d'une transplantation rénale provenant de donneurs positifs au cytomégalovirus. Afin d'élargir notre portefeuille de maladies infectieuses, nous avons conclu un accord de collaboration et de licence avec Gilead Sciences, Inc. pour la recherche et le développement de traitements fonctionnels contre le VIH et l'hépatite B. Nous construisons un pipeline d'immuno-oncologie exclusif en ciblant les antigènes du cancer à médiation virale, les auto-antigènes et les antigènes de nouvelle génération.
Pour plus d'information, consulter le site internet de la société www.hookipapharma.com.
*Enregistré en Europe; en cours d'enregistrement aux Etats-Unis .
|
Répondre
|
Valneva : reçoit un avis positif de l'EMA sur le plan de développement de son vaccin contre la maladie de Lyme
25/10/2018 | Comminqué de presse (PDF)
http://www.publicnow.com/view/0FC0AA748213FE05A79AD65A868E57F154CB534B
----------------------------------------------------------------------------------------
Campus Bio-Ouest | 6, Rue Alain Bombard 44800 Saint-Herblain,France
Valneva reçoit un avis positif de l'EMA sur le plan de développement de son vaccin contre la maladie de Lyme
Saint Herblain (France), 25 octobre 2018- Valneva SE ("Valneva" ou "le Groupe"),société de biotechnologie dédiée au développement, à la production et à la commercialisation de vaccins innovants, a annoncéaujourd'hui avoir reçu un avis positif de l'Agence Européennedes Médicaments (EMA) sur le plan de développement de son vaccin contre la maladie de Lyme, VLA15.
L'avis scientifique détaillé de l'EMA est en grande partie conforme aux discussions précédentes avec l'autorité de santé américaine, FDA,sur la stratégie de développement de VLA15 et confirme les hypothèses de développement élaborées par le Groupe.
Wolfgang Bender, MD, PhD, Chief Medical Officer de Valnevaa indiqué, « Obtenir un assentiment à la fois del'EMA et de la FDAvient renforcer la confiance que nous avons dans la stratégie de développement de notre candidat vaccin contre la maladie de Lyme. Nous continuerons au cours des prochaines étapes de développement à travailler en étroite collaborationavec les autorités réglementaires, avec comme objectif d'offrir une protection contre cette maladie souvent invalidante. »
Le Groupe confirme qu'il prévoit de lancer laPhase 2 de développement clinique de son vaccin fin 2018.
La Phase 2 intégrera de nouveaux dosages du vaccin et de nouveaux schémas de vaccination par rapport à ceux évalués en Phase 1.Les résultats d'immunogénicité et desécurité serviront à déterminer la meilleure dose et le meilleur schéma de vaccination.
Cette Phase 2 devrait être menée sur environ 800 sujets sur plus de 10 sites dans des zones endémiques aux Etats-Unis et en Europe. Elle inclurait des sujets ayant déjà été touchés par la maladiede Lyme ainsi que des sujets qui n'ont jamais été infectés.La Phase 2 devrait durer environ deux ans.
A propos de la maladie de Lyme
La maladie de Lyme est une infection systémique causée par la bactérieBorreliatransmise à l'homme par les tiques Ixodes1. Selon les organismes américains de contrôle et de prévention des maladies (CDC), environ 300 000 américains2sont diagnostiqués chaque année et au moins 200 000 cas seraient également recensés chaque année en Europe3.
Les premiers symptômes de la maladie (éruption érythémateuse ou d'autres symptômesmoins spécifiques tels que fatigue, fièvre, maux de tête, rigidité de la nuque, arthralgie ou myalgie) sont souvent ignorés ou mal interprétés. En cas de traitement tardif ou inadéquat de
1Stanek et al. 2012, The Lancet 379:461-473
2As estimated by the CDC based on reported cases in 2015
3Estimated from available national data. Number largely underestimated based on WHO Europe Lyme Report as case reporting is highly inconsistent in Europe and many LB infections go undiagnosed; ECDC tick-borne-diseases-meeting-report la maladie, l'infection peut conduire à de sévères complications articulaires (arthrite), cardiaques (cardite) ou du système nerveux central.
Le besoin médical pour un vaccin contre la maladie de Lyme ne cesse d'augmenter alors que la maladie continue de s'étendre géographiquement4.
A propos de VLA15
Le candidat vaccin de Valneva, VLA15, est actuellement le seul programme clinique actif contre la maladie de Lyme. Ce programme a reçule statut de "Fast track" de l'autorité desanté américaine, FDA, en juillet 20175et Valneva a publié des résultats initiaux de Phase 1 en mars 20186. VLA15 a montré un profil d'innocuité favorable et était immunogène danstoutes les doses et formulations testées démontrant une bonne réponse des anticorps IgGspécifiques de l'OspA contre tous les sérotypes d'OspA.
VLA15 est un nouveau vaccin multivalent à sous-unités de protéines ciblant la surface externe de la protéine A (OspA) de la Borrelia.L'indication ciblée par le candidat vaccin de Valnevaest une immunisation prophylactique active contre la maladie de Lyme avec pour objectifd'offrir une protection contre la majorité des sources de Borrelia pathogènes pour l'homme.
VLA15 est conçu pour offrir une protection contre la maladie de Lyme en augmentant leniveau d'anticorps empêchant la bactérie Borrelia de migrer de la tique à l'homme après une morsure. Le profil d'innocuité devrait être semblable à celui d'autres vaccins qui utilisent la même technologie et qui ont déjà été approuvés pour une immunisation active chez l'adulte et l'enfant.
La population ciblée par le vaccin inclut les individus à risques âgés de plus de deux ans vivant dans les zones endémiques, les personnes ayant prévu de voyager dans les zones endémiques et de pratiquer des activités de plein air ainsi que les personnes ayant déjà ététouchées par la maladie (puisqu'une infection par Borrelia ne confère pas d'immunité protectrice contre toutes les souches de Borrélia pathogènes pour l'homme).
La vaccination par OspA a déjà prouvé son efficacité dans les années 90 et les données précliniques du vaccin VLA15 ont révélé que ce candidat vaccin offrait une protection contre lamajorité des souches de Borrelia pathogènes pour l'homme7.
Le marché mondial pour un vaccin contre la maladie de Lyme est actuellement estimé à entre€700 et €800 millions par an.
A propos de Valneva SE
Valneva est une société de biotechnologie spécialisée dans le développement, la production et la commercialisation de vaccins innovants. Le portefeuille de produits de Valneva inclut deux vaccins du voyageur, IXIARO®/JESPECT®contre l'encéphalite japonaise, et DUKORAL®dans la prévention du choléra et, dans certains pays, de la diarrhée causée par L'ETEC. Legroupe est également propriétaire de vaccins en développement dont le seul candidat vaccin contre la maladie de Lyme. Valneva compte plus de 450 employés et exerce ses activités
4New Scientist, Lyme disease is set to explode and we still don't have a vaccine; March 29, 2017https://www.newscientist.com/article/mg23431195-800-lyme-disease-is-set-to-explode-and-you-cant-protect-yourself/
5http://www.valneva.com/en/investors-media/news/2018;
6Valneva Press Release March 19, 2018:Valneva Reports Positive Phase I Interim Results for Its Lyme Vaccine Candidate
VLA15.
7http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0113294.
depuis l'Autriche, la Suède, la Grande-Bretagne, la France, le Canada et les Etats-Unis. Pourplus d'information, consulter le site internet de la sociétéwww.valneva.com.
Valneva Investor and Media Contacts
Laetitia Bachelot-Fontaine
Teresa Pinzolits
Global Head of Investor Relations & Corporate Communications Specialist
Corporate Communications
T +43 (0)1 20620 1116
|
Répondre
|
Valneva : avancée de l'étude pour un vaccin du Chikungunya
16/10/2018 | Communiqué de presse
Valneva annonce avoir entamé la deuxième partie de l'étude de Phase 1 visant à développer un vaccin à injection unique contre le Chikungunya. Un premier groupe de participants reçoit actuellement une deuxième injection du vaccin.
Cette nouvelle immunisation a pour but, en exposant à nouveau les sujets au virus atténué, de démontrer dès la première phase de développement clinique de VLA1553, qu'ils sont protégés de la virémie induite par le vaccin.
L'essai clinique de Phase 1 de VLA1553 est conduit dans plusieurs centres cliniques sur environ 120 adultes sains et vaccinés avec une seule dose du vaccin. Le groupe de biotechnologie prévoit d'annoncer de premiers résultats début 2019.
|
Répondre
|
Valneva : décision de la FDA pour son vaccin IXIARO
05/10/2018 | 08:01
Valneva annonce aujourd'hui que l'autorité de santé américaine, FDA, a approuvé un schéma accéléré de vaccination de son vaccin IXIARO pour les voyageurs adultes (âgés de 18 à 65 ans).
' Ce schéma accéléré vient s'ajouter au schéma précédemment approuvé. IXIARO est le seul vaccin contre l'encéphalite japonaise approuvé et disponible aux EtatsUnis ' indique le groupe.
Le vaccin avait été initialement approuvé avec un schéma de vaccination comprenant deux injections séparées, administrées à 28 jours d'intervalle. Le schéma nouvellement approuvé permet désormais d'administrer les deux doses dans un intervalle de seulement sept jours.
Franck Grimaud, directeur général de Valneva, a indiqué, ' de nombreuses personnes organisent leur voyage au dernier moment et, de ce fait, pouvoir recevoir les deux injections d'IXIARO en sept jours facilite leurs préparatifs. Cela renforce également l'attractivité de notre produit. Les Etats-Unis représentent le principal marché d'IXIARO et nous espérons que ce nouveau schéma de vaccination va encourager davantage de voyageurs américains à opter pour une solution de prévention contre cette maladie dévastatrice '.
|
Répondre
|
Opération dilutive pour l'actionnaire du flottant...
Valneva : lève €50 millions principalement auprès d'investisseurs US dans le cadre d'un placement privé sursouscrit
27/09/2018 | 07:02 | Communiqué de presse
http://hugin.info/143334/R/2217989/866836.pdf
-----------------------------------------------------------------------------------------------------------
Saint-Herblain (France), 27 septembre 2018 - Valneva SE ("Valneva" ou "le Groupe"), société de biotechnologie dédiée au développement, à la production et à la commercialisation de vaccins innovants, a annoncé aujourd'hui une levée de fonds pour un montant total d'environ €50 millions dans le cadre d'un placement privé en actions ordinaires. L'opération, principalement souscrite par des investisseurs américains spécialistes du secteur de la santé et également soutenue par certains des principaux actionnaires du Groupe, a été sursouscrite.
Thomas Lingelbach, Président du directoire de Valneva, a indiqué : « Nous sommes ravis que de prestigieux fonds américains spécialistes du secteur de la santé aient décidé d'investir dans Valneva. Cet investissement vise à soutenir notre stratégie d'accès aux capitaux et notre croissance future, dont notamment l'accélération de nos programmes de développement clés. Nous sommes reconnaissants envers nos actionnaires existants pour leur soutien continu ».
La levée de fonds a été effectuée par le biais d'un placement privé réservé à des investisseurs qualifiés. Environ 81% des actions nouvelles ont été allouées à des investisseurs américains. Deux des principaux actionnaires de la société, Groupe Grimaud et MVM Life Science Partners, ont également participé à la levée. Groupe Grimaud et MVM Life Science Partners ont respectivement souscrit 12 % et 6 % des actions nouvelles à émettre. Sur cette base, après réalisation de l'augmentation de capital, le Groupe Grimaud et MVM Life Science Partners détiendront respectivement 15,1 % et 7,3 % du capital social du Groupe.
Guggenheim Securities, LLC et Oddo BHF ont agi en tant que Teneurs de Livre Associés.
Principales caractéristiques de l'opération
Un nombre total de 13.333.334 actions ordinaires nouvelles, d'une valeur nominale unitaire de €0,15 a été émis au profit d'investisseurs nouveaux et existants.
Les actions nouvelles, représentant environ 17% du capital social de la Société, sur une base non diluée, avant la réalisation de l'augmentation de capital, seront émises en vertu d'une décision du directoire du Groupe en date de ce jour, faisant usage, conformément à l'autorisation préalable du Conseil de Surveillance en date du 20 septembre 2018, de la délégation de compétence octroyée par la dix-septième résolution de l'assemblée générale mixte de la Société en date du 28 juin 2018 et sur le fondement des articles L. 225-136 du code de commerce et L. 411-2(II) du code monétaire et financier. A titre illustratif, un actionnaire détenant 1% du capital de Valneva avant le lancement de l'augmentation de capital détiendra dorénavant une participation de 0,85 %.
Le prix d'émission des actions nouvelles a été fixé à €3,75 par action, représentant une décote de 2,6% par rapport à la moyenne pondérée par les volumes des cours de bourse de l'action Valneva sur le marché réglementé d'Euronext Paris des 3 dernières séances de bourse précédant sa fixation (i.e. du 24 septembre au 26 septembre 2018 inclus), soit 3,85€.
Suite au règlement et à la livraison des actions nouvelles, le capital social du Groupe sera de €13.637.557 divisé en 90.917.048 actions d'une valeur nominale de €0,15. L'opération sera réalisée le 1er Octobre 2018.
Utilisation des fonds levés
Les fonds levés seront alloués au développement des programmes cliniques du Groupe, et notamment de ces candidats vaccins contre le Chikungunya et la maladie de Lyme, ainsi qu'au financement de son fonds de roulement et plus généralement de son activité. Le produit d'émission net vient renforcer la trésorerie du Groupe, qui s'élevait à €37,7 millions à fin juin 2018.
Admission des actions nouvelles
Les actions nouvelles porteront jouissance courante, donneront droit à toute distribution de dividende et seront immédiatement assimilées aux actions existantes du Groupe. Il est prévu qu'elles soient admises aux négociations sur la même ligne de cotation que les actions existantes de la Société (ISIN FR0004056851) le 1er Octobre 2018 sur le marché réglementé d'Euronext Paris et dès que possible sur le marché réglementé de la Bourse de Vienne (Autriche).
La levée de fonds ne donne pas lieu à un prospectus soumis au visa de l'Autorité des marchés financiers.
Engagement d'abstention et de conservation
Valneva a signé un engagement de conservation d'une durée de 90 jours après la date de règlement-livraison de l'augmentation de capital, sous réserves d'exceptions usuelles, qui limite la capacité de la société à émettre de nouvelles actions. Les membres du directoire ainsi que les membres du Conseil de surveillance de Valneva détenant des actions ou des Bons de Souscription d'Actions (BSA), ainsi que les trois principaux actionnaires de Valneva ont également signé des engagements concernant les actions qu'ils détiennent, limitant leur capacité à vendre ou transférer ces actions pendant une durée similaire de 90 jours.
Facteurs de risque
L'attention du public est portée sur les facteurs de risque relatifs au Groupe et son activité présentés en section 1.5 du rapport semestriel du Groupe publié le 2 août 2018 et en section A.5 du document de référence 2017 déposé auprès de l'Autorité des marchés financiers le 21 mars 2018 sous le numéro D.18-0159, disponible sans frais sur les sites internet du Groupe (www.valneva.com) et/ou de l'Autorité des marchés financiers (www.amf-france.org).
Ce communiqué ne constitue pas un prospectus en vertu de la directive Prospectus ou une offre au public.
A propos de Valneva SE
Valneva est une société de biotechnologie spécialisée dans le développement, la production et la commercialisation de vaccins innovants. Le portefeuille de produits de Valneva inclut deux vaccins du voyageur, IXIARO®/JESPECT® contre l'encéphalite japonaise, et DUKORAL® dans la prévention du choléra et, dans certains pays, de la diarrhée causée par L'ETEC. Le groupe est également propriétaire de vaccins en développement particulièrement uniques contre la maladie de Lyme et le Chikungunya. Valneva compte plus de 450 employés et exerce ses activités depuis l'Autriche, la Suède, la Grande-Bretagne, la France, le Canada et les Etats-Unis. Pour plus d'information, consulter le site internet de la société www.valneva.com.
Valneva Investor and Media Contacts
Laetitia Bachelot-Fontaine
Global Head of Investor Relations &
Corporate Communications
M +33 (0)6 4516 7099
investors@valneva.com
Teresa Pinzolits
Corporate Communications Specialist
T +43 (0)1 20620 1116
communications@valneva.com
|
Répondre
|
Valneva: résultats d'étude positifs contre le virus Zika
Actualité publiée le 20/11/18
Valneva et Emergent BioSolutions ont annoncé des résultats préliminaires positifs pour l'étude de phase 1 conçue pour évaluer l'innocuité et l'immunogénicité de leur candidat vaccin contre le virus Zika, VLA1601.
Ce candidat vaccin a en effet atteint le critère d'évaluation principal de l'étude en montrant un profil d'innocuité favorable pour toutes les doses et schémas de vaccination testés. Il a aussi démontré être immunogène dans tous les groupes vaccinés.
Cette étude de phase 1 est cofinancée par Emergent et Valneva dans le cadre d'un accord de licence mondiale exclusif signé en juillet 2017, accord qui inclut un droit d'option pour Emergent, exerçable une fois la phase 1 achevée.
|
Répondre
|
|
Répondre
|
La plupart des signaux sont au vert ! On s'oriente vers une phase haussière en creux et bosses ascensionnelle depuis le point bas de décembre 2017 ...
.

|
Répondre
|
Quel est le support à tenir aujourd’hui et sommes nous toujours dans la fourchette que tu avais tracée?
Merci à toi et serrons les fesses on aura le droit à des jours meilleurs

|
Répondre
|
|
Répondre
|
 Suivez les marchés avec des outils de pros !
Suivez les marchés avec des outils de pros !