DBV + 80% ! Allergie arachides ! SUPER nouvelle
Cours temps réel: 2,48 -2,75%| Cours | Graphes | News | Analyses et conseils | Société | Historiques | Vie du titre | Secteur | Forum |
Ça fait quelques années que j'attends la bonne nouvelle. Mais lesquelle ?
|
Répondre
|
Enfin ! 🤑👍
|
Répondre
|
C'est facile a dire mais pas évident a faire
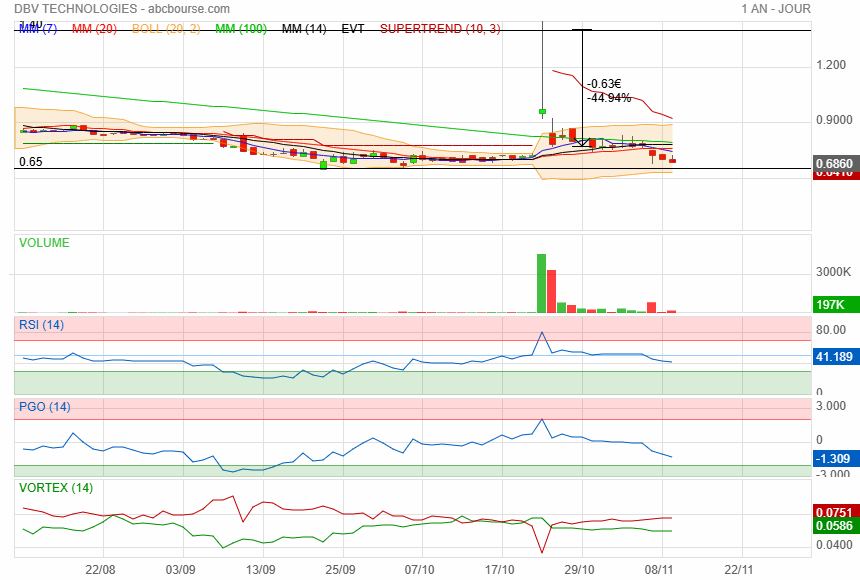
même scotché sur ce genre de boite faut avoir le courage de vendre quand il y a explosion et éventuellement revenir sur le titre au plus bas par la suite
|
Répondre
|
Et voila un plus bas, société de merde comme toutes ces entreprises francaises mal gouverné ou les dirigeants s'octroies des salaires de dingues !!!
|
Répondre
|
C'est bien ce que je craignais........une société de merde avec des dirigeants de merde qui j'en suis certain se donnent des salaires de prince comme la plupart des biotechs françaises
|
Répondre
|
Bonjour Twarog, le père Noêl c'est pour les enfants.......pas pour la bourse. Désolé pour toi et moi.
|
Répondre
|
Ça va repartir dans avenir très proche ! 😤🥳👋
|
Répondre
|
+10% !
Je attends depuis 3 ans je peux attendre encore 3 mois ! Si en janvier FDA accepte pour l’enfant 1-3 ans peut être je vais retrouver mon PRU 😮💨🥴👋
« Notre accord avec la FDA sur une procédure accélérée pour le patch Viaskin Peanut chez enfants âgés de 1 à 3 ans représente une étape importante dans la mise à disposition de ce nouveau traitement pour les patients », a déclaré Daniel Tassé, Directeur Général de DBV Technologies. « Je suis heureux que la FDA reconnaisse le besoin médical urgent non satisfait qui existe pour cette jeune population de patients. Nous sommes également très satisfaits de l’avis scientifique reçu de l’EMA, à savoir un patch unique pour les enfants allergiques à l’arachide âgés de 1 à 7 ans, dès lors que l’étude d’innocuité avec le patch modifié chez les 1 à 3 ans aura été réalisée ».
Patch Viaskin Peanut chez les enfants de 1 à 3 ans
Procédure d’approbation accélérée
Les directives de la FDA relatives à l’approbation accélérée comprennent trois critères de qualification : 1) le produit doit traiter une maladie grave, 2) le produit doit apporter un avantage significatif par rapport aux thérapies disponibles, et 3) le produit doit démontrer un effet sur un critère clinique intermédiaire, raisonnablement susceptible de prédire un bénéfice clinique.
La FDA a confirmé que DBV a déjà satisfait aux critères 1 et 2. En ce qui concerne le critère 3, la FDA a fourni des orientations et des suggestions concernant le critère clinique intermédiaire, que DBV a accepté lors de discussions informelles avec la FDA. DBV prévoit de formaliser ces directives en sollicitant une réunion formelle pour confirmer les composantes générales des deux études concernées : l’étude d’innocuité COMFORT Toddlers, qui doit être achevée avant le dépôt du BLA, ainsi que l’étude de confirmation d’efficacité, y compris le troisième critère d’approbation accélérée relatif au critère clinique intermédiaire. DBV prévoit que l’étude de confirmation soit lancée au moment du dépôt du BLA, et se déroule parallèlement à la commercialisation aux États-Unis, si Viaskin Peanut est approuvé.
|
Répondre
|
faites vos jeux
|
Répondre
|
Je attends depuis 3 ans je peux attendre encore 3 mois ! Si en janvier FDA accepte pour l’enfant 1-3 ans peut être je vais retrouver mon PRU 😮💨🥴👋
« Notre accord avec la FDA sur une procédure accélérée pour le patch Viaskin Peanut chez enfants âgés de 1 à 3 ans représente une étape importante dans la mise à disposition de ce nouveau traitement pour les patients », a déclaré Daniel Tassé, Directeur Général de DBV Technologies. « Je suis heureux que la FDA reconnaisse le besoin médical urgent non satisfait qui existe pour cette jeune population de patients. Nous sommes également très satisfaits de l’avis scientifique reçu de l’EMA, à savoir un patch unique pour les enfants allergiques à l’arachide âgés de 1 à 7 ans, dès lors que l’étude d’innocuité avec le patch modifié chez les 1 à 3 ans aura été réalisée ».
Patch Viaskin Peanut chez les enfants de 1 à 3 ans
Procédure d’approbation accélérée
Les directives de la FDA relatives à l’approbation accélérée comprennent trois critères de qualification : 1) le produit doit traiter une maladie grave, 2) le produit doit apporter un avantage significatif par rapport aux thérapies disponibles, et 3) le produit doit démontrer un effet sur un critère clinique intermédiaire, raisonnablement susceptible de prédire un bénéfice clinique.
La FDA a confirmé que DBV a déjà satisfait aux critères 1 et 2. En ce qui concerne le critère 3, la FDA a fourni des orientations et des suggestions concernant le critère clinique intermédiaire, que DBV a accepté lors de discussions informelles avec la FDA. DBV prévoit de formaliser ces directives en sollicitant une réunion formelle pour confirmer les composantes générales des deux études concernées : l’étude d’innocuité COMFORT Toddlers, qui doit être achevée avant le dépôt du BLA, ainsi que l’étude de confirmation d’efficacité, y compris le troisième critère d’approbation accélérée relatif au critère clinique intermédiaire. DBV prévoit que l’étude de confirmation soit lancée au moment du dépôt du BLA, et se déroule parallèlement à la commercialisation aux États-Unis, si Viaskin Peanut est approuvé.
|
Répondre
|
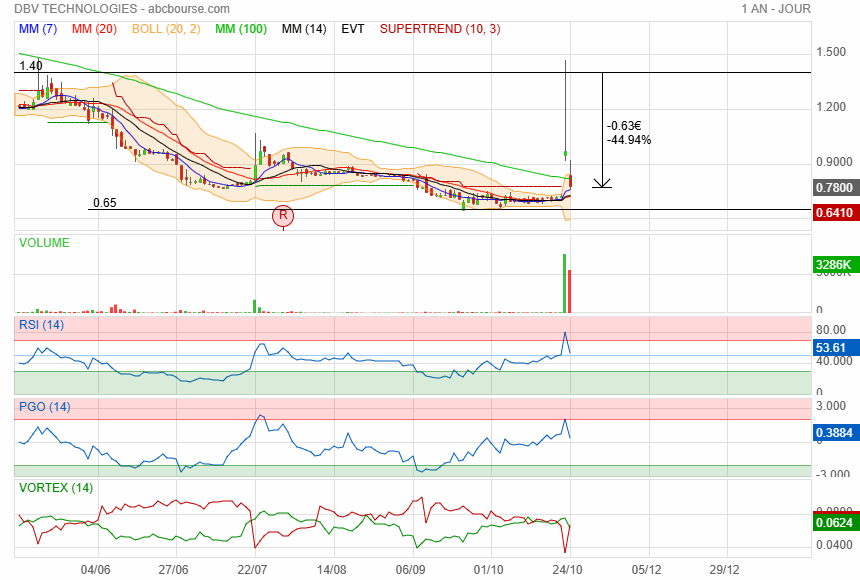
Et maintenant-50%,une grosse merde !!!
|
Répondre
|
Eh oui, tout le monde s'est jeté dessus, et aujourd'hui patatra........c'est DBV ........une merde.
|
Répondre
|
Moi je suis bloqué avec PRU énorme ! Seulement D’accord FDA va me libérer… 🥴😤👋
|
Répondre
|
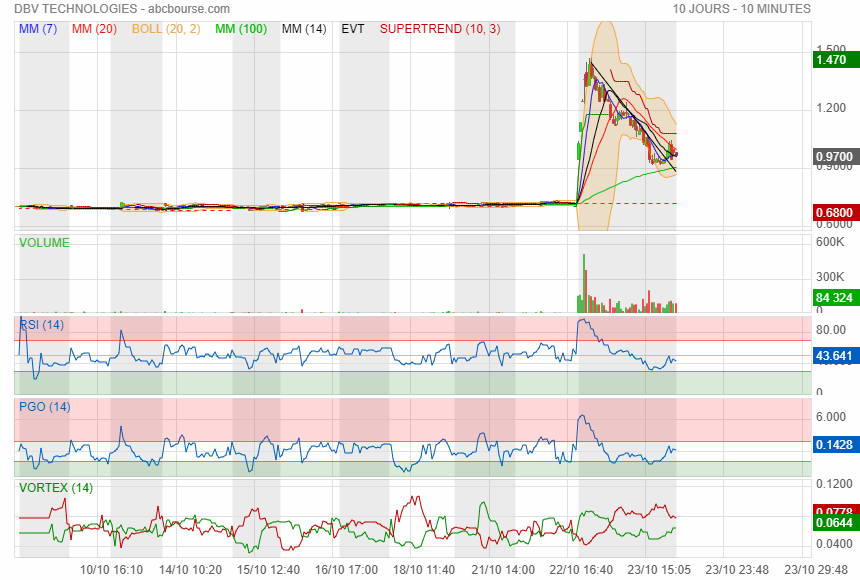
en tous les cas c était pas la bonne journée pour acheter !
on verra demain si elle referme le GAP
|
Répondre
|
« Notre accord avec la FDA sur une procédure accélérée pour le patch Viaskin Peanut chez enfants âgés de 1 à 3 ans représente une étape importante dans la mise à disposition de ce nouveau traitement pour les patients », a déclaré Daniel Tassé, Directeur Général de DBV Technologies. « Je suis heureux que la FDA reconnaisse le besoin médical urgent non satisfait qui existe pour cette jeune population de patients. Nous sommes également très satisfaits de l’avis scientifique reçu de l’EMA, à savoir un patch unique pour les enfants allergiques à l’arachide âgés de 1 à 7 ans, dès lors que l’étude d’innocuité avec le patch modifié chez les 1 à 3 ans aura été réalisée ».
Patch Viaskin Peanut chez les enfants de 1 à 3 ans
Procédure d’approbation accélérée
Les directives de la FDA relatives à l’approbation accélérée comprennent trois critères de qualification : 1) le produit doit traiter une maladie grave, 2) le produit doit apporter un avantage significatif par rapport aux thérapies disponibles, et 3) le produit doit démontrer un effet sur un critère clinique intermédiaire, raisonnablement susceptible de prédire un bénéfice clinique.
La FDA a confirmé que DBV a déjà satisfait aux critères 1 et 2. En ce qui concerne le critère 3, la FDA a fourni des orientations et des suggestions concernant le critère clinique intermédiaire, que DBV a accepté lors de discussions informelles avec la FDA. DBV prévoit de formaliser ces directives en sollicitant une réunion formelle pour confirmer les composantes générales des deux études concernées : l’étude d’innocuité COMFORT Toddlers, qui doit être achevée avant le dépôt du BLA, ainsi que l’étude de confirmation d’efficacité, y compris le troisième critère d’approbation accélérée relatif au critère clinique intermédiaire. DBV prévoit que l’étude de confirmation soit lancée au moment du dépôt du BLA, et se déroule parallèlement à la commercialisation aux États-Unis, si Viaskin Peanut est approuvé.
|
Répondre
|
+55% 🧐
|
Répondre
|
DBV Technologies : bondit après des avancées pour son patch Viaskin Peanut
Le 23 octobre 2024 à 09:42
DBV (+57,95% à 1,14 euro) décolle et affiche la plus forte hausse du marché SRD après avoir annoncé des avancées règlementaires positives pour le patch Viaskin Peanut contre l'allergie aux arachides, aux États-Unis et en Europe. La biotech évoque en particulier une procédure d’approbation accélérée pour ce patch chez les enfants âgés de 1 à 3 ans, en accord avec les directives de la Food and Drug Administration (FDA) américaine. Elle a également reçu un avis scientifique de l'EMA sur une indication pour les enfants âgés de 1 à 7 ans en Europe.
DBV va solliciter une réunion formelle auprès de la FDA afin de préciser ses directives dans le cadre de la procédure d'approbation accélérée chez les 1-3 ans.
|
Répondre
|
Forum de discussion Dbv Technologies
202510031255 1049547
 Suivez les marchés avec des outils de pros !
Suivez les marchés avec des outils de pros !